
 请运用化学反应原理的相关知识研究碳及其化合物的性质.
请运用化学反应原理的相关知识研究碳及其化合物的性质.| 1 |
| 2 |
| 1 |
| 2 |
| 总质量 |
| 体积 |
| c(CH3OH) |
| c(CO)?c2(H2) |
| 0.5 |
| 0.5×0.5×0.5 |
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:
| A、Na2CO3和NaHCO3的混合溶液中一定存在:c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-) |
| B、1mol Cl2通入含1mol FeBr2的溶液中发生反应的离子方程式:Cl2+2Br-=2Cl-+Br2 |
| C、能使甲基橙显红色的溶液中大量存在:Mg2+、I-、Cl-、NO3- |
| D、从C(石墨)=C(金刚石)△H=+1.9kJ?mol-1,可知金刚石比石墨更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(HA) |
| A、②④⑥ | B、①③⑥⑦ |
| C、②④⑥⑦ | D、①②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知在一定条件下的反应4HCl+O2=2Cl2+2H2O中,有4mol HCl被氧化时,放出
(1)已知在一定条件下的反应4HCl+O2=2Cl2+2H2O中,有4mol HCl被氧化时,放出| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ?mol-1) | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:
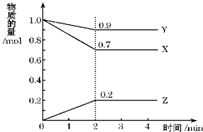 (1)在101kPa时,CO在1.0mol O2中完全燃烧,生成2.0mol CO2,放出566.0kJ的热量,则此反应的热化学方程:
(1)在101kPa时,CO在1.0mol O2中完全燃烧,生成2.0mol CO2,放出566.0kJ的热量,则此反应的热化学方程:查看答案和解析>>
科目:高中化学 来源: 题型:
 托盘天平、容量瓶、滴定管、量筒是中学化学常见的计量仪器,熟知这些仪器的使用是定量研究化学的基础.
托盘天平、容量瓶、滴定管、量筒是中学化学常见的计量仪器,熟知这些仪器的使用是定量研究化学的基础.查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com