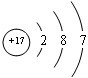
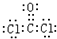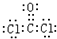(2012?醴陵市模拟)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO
3大量地用于电镀工业中.
(1)CrO
3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若在硫酸溶液中乙醇被氧化成乙酸,CrO
3被还原成绿色的硫酸铬[Cr
2(SO
4)
3].则该反应的离子方程式为
4CrO3+3CH3CH2OH+12H+═4Cr3++3CH3COOH+9H2O
4CrO3+3CH3CH2OH+12H+═4Cr3++3CH3COOH+9H2O
.
(2)存在平衡:2CrO
42ˉ(黄色)+2H
+?Cr
2O
72ˉ(橙色)+H
2O
①若平衡体系的pH=2,则溶液显
橙色
橙色
色.
②能说明该反应达平衡状态的是
bc
bc
.
a.Cr
2O
72ˉ和CrO
42ˉ的浓度相同
b.2V
正(Cr
2O
72ˉ)=V
逆(CrO
42ˉ)
c.溶液的颜色不变
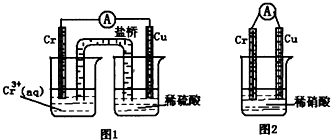
(3)在图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体.由图1知金属铬的活动性比铜
强
强
(填强,弱),图2装置中铬电极的电极反应式:
NO3-+4H++3eˉ=NO↑+2H2O
NO3-+4H++3eˉ=NO↑+2H2O
.
(4)CrO
3和K
2Cr
2O
7均易溶于水,这是工业上造成铬污染的主要原因.净化处理方法之一是将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe
2+和Cr
2O
72ˉ发生反应,生成的Fe
3+和Cr
3+在阴极区与OHˉ结合生成Fe(OH)
3和Cr(OH)
3沉淀除去[已知KspFe(OH)
3=4.0×10
-38,KspCr(OH)
3=6.0×10
-31].
①电解过程中NaCl的作用是
增强溶液的导电性
增强溶液的导电性
.
②已知电解后的溶液中c(Fe
3+)为2.0×10
-13mol/L,则溶液中c(Cr
3+)为:
3.0×10ˉ6
3.0×10ˉ6
mol/L.




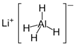 )、LiH是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法不正确的是( )
)、LiH是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法不正确的是( )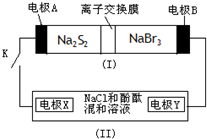 (2012?醴陵市模拟)如图所示,装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为电解池,装置(Ⅰ)的离子交换膜只允许Na+通过.电池充、放电的化学方程式为:
(2012?醴陵市模拟)如图所示,装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为电解池,装置(Ⅰ)的离子交换膜只允许Na+通过.电池充、放电的化学方程式为: