
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
Ⅰ:配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于
________晶体.
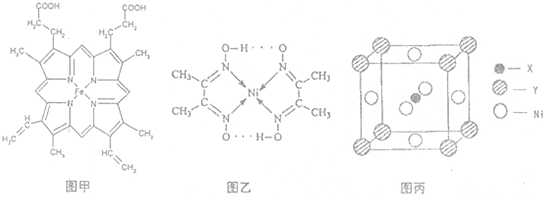
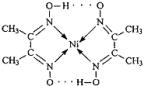
Ⅱ:配合物 分子内的作用力有________(填编号).
分子内的作用力有________(填编号).
A.氢键
B.离子键
C.共价键
D.金属键
Ⅲ:氢气是新型清洁能源,但难储运.研究发现,合金可用来储藏氢气.镧(![]() )和镍(
)和镍(![]() )的一种合金就是储氢材料.该合金的晶胞如图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上.储氢时氢原子存在于金属原子之间的空隙中.
)的一种合金就是储氢材料.该合金的晶胞如图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上.储氢时氢原子存在于金属原子之间的空隙中.

(1)一定条件下,该贮氢材料能快速、可逆地存储和释放氢气,若每个晶胞可吸收3个H2,这一过程用化学方程式表示为:________.
(2)下列关于该贮氢材料及氢气的说法中,正确的是________(填序号)
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
C.该材料贮氢时采用常温高压比采用常温常压更好
D.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
(3)Ni(CO)6为正八面体结构,镍原子位于正八面体的中心,配位体CO在正八面体的六个顶点上.若把其中两个CO配位体换成NH3得到新的配合物,则以下物质中互为同分异构体的是________.(填字母编号,任填一组)(图中黑点为NH3,圆圈为CO,Ni略去)

科目:高中化学 来源: 题型:
 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 ,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为
,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为查看答案和解析>>
科目:高中化学 来源: 题型:
 (2009?珠海二模)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
(2009?珠海二模)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力. 分子内的作用力有
分子内的作用力有 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有查看答案和解析>>
科目:高中化学 来源: 题型:
 分子内的作用力有
分子内的作用力有 等,其中碳原子采取sp2杂化的分子有
等,其中碳原子采取sp2杂化的分子有
查看答案和解析>>
科目:高中化学 来源: 题型:
 分子内的作用力有
分子内的作用力有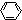 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有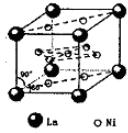
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com