
分析 常温下用0.2mol•L-1 HA溶液与0.2mol•L-1 NaOH溶液等体积混合,二者恰好完全反应生成NaA,测得混合溶液中c(Na+)>c(A-),说明A-水解导致c(Na+)>c(A-),则HA是弱酸;
(1)测得混合溶液中c(Na+)>c(A-),根据电荷守恒判断溶液中c(H+)、c(OH-)相对大小,从而确定混合溶液酸碱性;
(2)任何电解质溶液中都存在物料守恒,根据物料守恒计算;
(3)如果取0.2mol/L HA溶液与 0.1mol/L NaOH 溶液等体积混合,则溶液中的溶质是NaA和HA,且二者的物质的量浓度相等,测得混合溶液的pH<7,说明酸的电离程度大于酸根离子的水解程度;
(4)①该二元酸第一步完全电离、第二步部分电离,Na2A中阴离子水解导致溶液呈碱性;
②A.该二元酸第一步完全电离、第二步部分电离,所以溶液中不存在H2A;
B.溶液中存在质子守恒;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.溶液中存在物料守恒,根据物料守恒判断;
③根据电离方程式知,HA-只电离不水解,0.1mol•L-1NaHA溶液的pH=2,则HA-电离出氢离子浓度为0.01mol/L,H2A第一步电离出的氢离子抑制第二步电离.
解答 解:常温下用0.2mol•L-1 HA溶液与0.2mol•L-1 NaOH溶液等体积混合,二者恰好完全反应生成NaA,测得混合溶液中c(Na+)>c(A-),说明A-水解导致c(Na+)>c(A-),则HA是弱酸;
(1)测得混合溶液中c(Na+)>c(A-),根据电荷守恒得溶液中c(H+)<c(OH-),溶液呈碱性,是因为A-水解导致溶液呈碱性,水解方程式为A-+H2O?HA+OH-,
故答案为:碱;A-+H2O?HA+OH-;
(2)二者等体积混合后溶液体积增大一倍,则浓度降为原来的一半,任何电解质溶液中都存在物料守恒,根据物料守恒得c(HA)+c(A-)=0.1mol•L-1,
故答案为:=;
(3)如果取0.2mol/L HA溶液与 0.1mol/L NaOH 溶液等体积混合,则溶液中的溶质是等物质的量浓度的NaA和HA,测得混合溶液的pH<7,混合溶液呈酸性,说明酸的电离程度大于酸根离子的水解程度,故答案为:大于;
(4)①该二元酸第一步完全电离、第二步部分电离,Na2A中阴离子水解导致溶液呈碱性,水解离子方程式为A 2-+H2O?HA-+OH-,
故答案为:碱性;A2-+H2O?HA-+OH-;
②A.该二元酸第一步完全电离、第二步部分电离,所以溶液中不存在H2A,存在物料守恒为c(A2-)+c(HA-)=0.1mol•L-1,故错误;
B.根据质子守恒得c(OH-)=c(H+)+c(HA-),故正确;
C.根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),故正确;
D.根据物料守恒得c(Na+)=2c(A2-)+2c(HA-),故正确;
故选BCD;
③根据电离方程式知,HA-只电离不水解,0.1mol•L-1NaHA溶液的pH=2,则HA-电离出氢离子浓度为0.01mol/L,H2A第一步完全电离生成0.1mol/L的氢离子,第一步电离出的氢离子抑制第二步电离,所以第二步电离出的氢离子浓度小于0.01mol/L,则H2A溶液中氢离子的物质的量浓度应小于0.11mol/L,
故答案为:<.
点评 本题考查酸碱混合溶液定性判断、弱电解质的电离及盐类水解等知识点,为高频考点,侧重考查学生分析判断能力,明确弱电解质电离特点是解本题关键,注意(4)题中二元酸第一步、第二步电离区别,注意该二元酸溶液中不存在H2A,为易错点.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
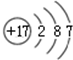 ②
②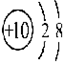 ③
③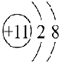 ④
④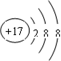
| A. | ①②两种粒子所属的元素在元素周期表的同一横行 | |
| B. | ②③④对应的元素化学性质相似 | |
| C. | ①③对应的元素是同一周期元素 | |
| D. | ③④可形成X2Y型化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
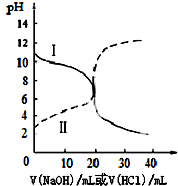 25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用浓度均为0.1mol•L-1NaOH溶液和盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )
25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用浓度均为0.1mol•L-1NaOH溶液和盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )| A. | 曲线Ⅰ:滴加溶液到20 mL时溶液的pH=5则:c(H+)-c((NH3•H2O)=c(OH-)=1×10-9 mol•L-1 | |
| B. | 曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) | |
| D. | 曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
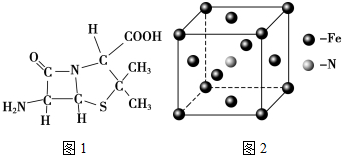
 )分子中有5n个σ键
)分子中有5n个σ键| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L CH3COOH溶液 | B. | 0.01mol/L HNO3溶液 | ||
| C. | pH=2的H2SO4溶液 | D. | pH=2的CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉在空气中易变质,所以应密封保存 | |
| B. | 工业上可用铁质容器存放浓硫酸 | |
| C. | 液氯可储存在钢瓶中,便于运输和使用 | |
| D. | 硅酸钠的水溶液俗称“水玻璃”,可保存在带玻璃塞的细口瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下硫的氧化物都是气体,通入水中都形成强酸 | |
| B. | 将FeCl3滴入饱和H2S溶液中,溶液的pH降低 | |
| C. | 将CO2通入CaSO4溶液中,无明显现象 | |
| D. | 充分利用含硫矿物,既可实现资源的有效利用,还可减轻酸雨污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com