
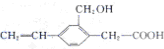
| A. | 该有机化合物的分子式为C11H10O3 | |
| B. | 该有机化合物能发生取代反应、加成反应和加聚反应 | |
| C. | 1mol该有机化合物分别消耗Na、NaOH和NaHCO3的物质的量之比为2:2:1 | |
| D. | 该有机化合物与 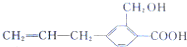 互为同系物 互为同系物 |
分析 由结构可知,分子中含碳碳双键、-OH、-COOH,结合烯烃、醇、羧酸的性质来解答.
解答 解:A.该有机化合物的分子式为C11H12O3,故A错误;
B.含-OH、-COOH可发生取代反应,含碳碳双键可发生加成、加聚反应,故B正确;
C.只有-COOH与NaOH和NaHCO3反应,则1mol该有机化合物分别消耗Na、NaOH和NaHCO3的物质的量之比为2:1:1,故C错误;
D.二者分子式相同,结构不同,互为同分异构体,故D错误;
故选B.
点评 本题考查有机物的结构和性质,侧重于学生的分析能力的考查,为高考常见题型,注意把握有机物的结构和官能团的性质为解答该类题目的关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
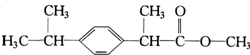 某种药物主要成分X的分子结构如图,关于有机物X的说法中错误的是( )
某种药物主要成分X的分子结构如图,关于有机物X的说法中错误的是( )| A. | ①④ | B. | ②④ | C. | ②③ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某溶液中,可能含有下表所列离子中的某几种:
某溶液中,可能含有下表所列离子中的某几种:| 阳离子 | Al3+、Mg2+、NH4+、Na+ |
| 阴离子 | CO32-、SiO32-、[Al(OH)4]-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和NaOH溶液时溶液的pH变大 | |
| B. | 在镀件上电镀铜时,可以不用金属铜做阳极,只要溶液中存在Cu2+就可以 | |
| C. | 电解稀硫酸制O2、H2时,铜做阳极 | |
| D. | 铝-空气燃料电池通常以NaOH溶液为电解液,电池在工作过程中电解液的pH保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铅蓄电池的A极为正极,电极材料为PbO2 | |
| B. | 铅蓄电池放电时负极质量增加 | |
| C. | 该电解池的阴极反应为:2 NO3-+6H2O+10e-═N2↑+2OH- | |
| D. | 若电路中流过2mol电子,则阳极室溶液质量减少32g(忽略气体的溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 溶液 | A | B | C | D | E |
| 5mol/LH2SO4 mL | 40 | V1 | V2 | V3 | V4 |
| 饱和CuSO4液 mL | 0 | 1 | 2 | V5 | 10 |
| H2O mL | V6 | V7 | V8 | 5 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com