
��1��SO2��ƽ��Ũ��Ϊ0.05 mol��L-1??
��2��O2��ת��������O2��=40%?
��3��ƽ��ʱ�����������Ϊ3.4 mol��?
��4��SO3��ƽ�������еĺ���Ϊ50%��?
��5��ƽ��������ƽ����Է�������Ϊ60��?
��6��O2��ƽ��Ũ��Ϊ0.11 mol��L-1??
��7����ƽ��ʱ������ѹǿ��С��1/5��?
��8������������ѹǿ���䣬���ƽ��ʱ���������Ϊ9 L��???????????
��1��75%����2��80%����3��60%����4��80%����5��80%��(6)90%��(7)80%��(8)40%��������1�����ݼ�����ʽ?
������������������������2SO2+O2![]() 2SO3?
2SO3?
��ʼŨ��/mol��L-1 0.2 0.2 0?
ת��Ũ��/mol��L-1?
ƽ��Ũ��/mol��L-1 0.05?
������SO2��=�ۣ�0.2-0.05��/0.2�ݡ�100%=75%?
��2���ݸ�����ת����֮�ȵ��ڻ�ѧ����ʽ��������ʵĻ�ѧ�����������SO2��ת����Ϊ2��40%��2=1.6 mol?
������SO2��=1.6 mol/2 mol��100%=80%?
(3)��O2��ת����Ϊx����?
������������������2SO2+O2![]() 2SO3��n��?
2SO3��n��?
��ʼ��/mol 2��+ 2��+ 0��=��4?
ת����/mol 2x x 2x?
ƽ����/mol 2-2x 2-x 2x?
��n(ƽ)=��2-2x��+(2-x)+2x=4-x??
�����⣺4 mol-x=3.4 molx=0.6 mol?
SO2��ת����=2x=2��0.6 mol=1.2 mol?
������(SO2)=1.2 mol/2 mol��100%=60%?
��4��Ҳ��O2��ת����Ϊx��ƽ��ʱ����Ϊ4-x?
����������2x/4-x��100%=50%?
���x=0.8 mol����?
��(SO2)=![]() ��100%=80%?
��100%=80%?
��5����![]() =m�ܣ�/n���ܣ�n���ܣ�=M���ܣ�/
=m�ܣ�/n���ܣ�n���ܣ�=M���ܣ�/![]() ?
?
����n���ܣ�=��64��2+32��2�� g/60 g��mol-1=3.2 mol?
����4 mol-x=3.2 molx=0.8 mol?
����(SO2)=2��0.8/2��100%=80%?
��6�������O2��ת����?
n(O2ת��)=2 mol-0.11��10 mol=0.9 mol?
����(SO2)=0.9��2/2��100=90%?
��7���������⣺p![]() ��p
��p![]() =��1-1/5����1=4��5?
=��1-1/5����1=4��5?
���µ����������ѹǿ�ȵ��������ʵ���֮�ȡ�������4 mol-x����4=4��5���x=0.8 mol������(SO2)=(0.8��2)/2��100%=80%?
��8�����µ�ѹ�£����������ȵ��������ʵ���֮�ȡ�����4 mol-x����4=9��10�����x=0.4 mol����(SO2)=��0.4��2��/2��100%=40%


 ���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011�����ĺ���һ�и�����ѧ����ĩ���ԣ����ۣ���ѧ���� ���ͣ������
��14�֣� �����ǹ�ҵ������һ����Ҫ�Ļ�����Ʒ���ҹ���ҵ�����������Ҫ�����ǽӴ�������Ҫԭ��Ϊ��������ش��������⣺
��1����֪���ջ�����Ļ�ѧ����ʽΪ 4FeS2 + 11O2
�÷�Ӧ������������������֮��Ϊ ����״̬�µõ�4.48��SO2 ʱ��һ��ת���� mol e������ÿ��3�֣�
��2����֪�¶ȡ�ѹǿ��SO2ƽ��ת���ʵ�Ӱ�����±���ʾ�������ϱ��ش�SO2ת����SO3��
��ѷ�Ӧ������ ����ÿ��2�֣�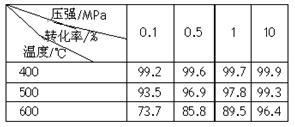
| A��400��500�� 0.1 MPa | B��400��10 MPa |
| C��500��10 MPa | D��400��500��1 MPa |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�츣��ʡ��һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��2 mol SO2��1 mol O2����һ�ݻ��̶����ܱ������У���һ�������·�����Ӧ��2SO2��g��+O2��g�� 2SO3(g)��������Щ�����ٱ仯ʱ��������˵����ѧ��Ӧ�Ѵ�ƽ��״̬(�� ��)
2SO3(g)��������Щ�����ٱ仯ʱ��������˵����ѧ��Ӧ�Ѵ�ƽ��״̬(�� ��)
A�����������ܶ� B����������ѹǿ
C���������������ʵ��� D����������ƽ����Է�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014���㽭ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��Ӧ��2SO2(g)��O2(g)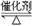 2SO3(g) ��H��0��ij�¶��£���2 mol SO2��
2SO3(g) ��H��0��ij�¶��£���2 mol SO2��
1 mol O2����10 L����ɱ���ܱ������У���Ӧ��ƽ���SO2��ƽ��ת����(��)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ����ʾ��������˵����ȷ����
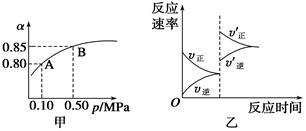
A����ͼ��֪��A��SO2��ƽ��Ũ��һ��Ϊ0.04 mol/L
B����ͼ��֪��B��SO2��O2��SO3��ƽ��Ũ��֮��Ϊ2��1��2
C����ƽ�����С�����ݻ�����Ӧ���ʱ仯ͼ�������ͼ�ұ�ʾ
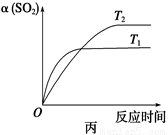
D��ѹǿΪ0.50 MPaʱ��ͬ�¶���SO2ת�������¶ȹ�ϵ���ͼ����T2��T1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com