
【题目】(1)无机化合物可以根据其组成和性质进行分类:

上图所示的物质分类方法名称是________。
(2)现有以下物质:①NaCl晶体 ②液态SO3 ③液态的醋酸 ④汞 ⑤BaSO4固体 ⑥蔗糖(C12H22O11) ⑦酒精(C2H5OH) ⑧熔融的K2SO4 ⑨纯水。请回答下列问题(用序号):
以上物质中能导电的是________属于电解质的是__________属于非电解质的是______________
【答案】树状分类法 ④⑤ ①⑤⑧⑨ ②⑥⑦
【解析】
(1)图示方法将无机化合物分成酸、碱、盐、氧化物、氢化物等,按照层次,符合树状分类的特点,属于树状分类,故答案为:树状分类法;
(2)①NaCl晶体不能导电,在水溶液中能导电,是电解质;②液态SO3不能导电,是非电解质;③液态的醋酸属于酸,在水溶液中能导电,是电解质;④汞是金属单质,能导电,既不是电解质也不是非电解质;⑤BaSO4固体是盐,熔融状态下能导电,是电解质;⑥蔗糖(C12H22O11)是有机物,在水溶液和熔融状态下都不导电,是非电解质;⑦酒精(C2H5OH)是有机物,在水溶液和熔融状态下都不导电,是非电解质;⑧熔融的K2SO4是盐,可以导电,是电解质;⑨纯水是电解质,不能导电;以上物质中能导电的是④⑤;属于电解质的是①⑤⑧⑨;属于非电解质的是②⑥⑦。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】如图某工厂用NO气体制取NH4NO3溶液,下列说法正确的是
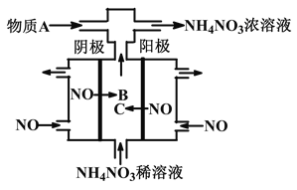
A. 阳极的电极反应式为:NO-3e-+2H2O=NO2-+4H+
B. 物质B与物质C是同一种物质
C. A物质可为氨气
D. 阴、阳两极转移的电子数之比为5∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物有广泛应用。
(1)工业冶炼铝,以石墨为阳极。阳极反应式为________,可能发生副反应有_______。
(2)一氧化碳和空气在酸性介质中构成燃料电池,负极反应式为___________。
(3)向75 mL 4 molL-1KOH溶液中缓慢通入4480 mL CO2气体(标准状况)恰好完全被吸收。
①写出该反应的离子方程式:___________________________。
②该吸收溶液中离子浓度大小排序为_________________________。
③常温下,a molL-1KHCO3溶液的pH=8,HCO3的水解常数约等于__________。(用含a式表示)。
(4)已知:① 2H2(g)+O2(g)=2H2O(l) △H1= —571.6kJmol-1
② 2CO(g)+O2(g)=2CO2(g) △H2 = —566.0kJmol-1
③ CO(g)+2H2(g)![]() CH3OH(g) △H3 = —90.8kJmol-1
CH3OH(g) △H3 = —90.8kJmol-1
计算甲醇蒸气的燃烧热△H=_______________。
(5)某温度下,发生可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.0kJ/mol,向某容器中充入1.0 molH2和1.0 mol(g),在一定条件下发生上述反应。混合气体中CO的物质的量与时间关系如下列所示:
CO2(g)+H2(g) △H=-41.0kJ/mol,向某容器中充入1.0 molH2和1.0 mol(g),在一定条件下发生上述反应。混合气体中CO的物质的量与时间关系如下列所示:
0 | 5 min | 10 min | 15 min | 20 min | 25 min | |
I(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
II(800℃) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
相对实验I,实验II可能改变的条件可能是________,该温度下,平衡常数=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入350mL 2molL﹣1的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A. 0.21 molB. 0.25 molC. 0.3 molD. 0.35 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.向某溶液中加入硝酸银溶液,生成白色沉淀,说明原溶液中有Cl-
B.向某溶液中加入氯化钡溶液,生成白色沉淀,说明原溶液中有![]()
C.向某溶液中加入氢氧化钠溶液,生成蓝色沉淀,说明原溶液中有Cu2+
D.向某溶液中加入盐酸后有无色气体逸出,此气体能使澄清石灰水变浑浊,可判定含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭系统中有反应C(s)+CO2(g)![]() 2CO(g),能使反应速率加快的措施是( )
2CO(g),能使反应速率加快的措施是( )
①通过减小容器体积增大压强②升高温度 ③将炭粉碎 ④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2.
A. ①②③⑥B. ①②④⑥C. ①②③④D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)![]() Z(g) ΔH<0,反应经60 s达到平衡并生成0.3 mol Z,则下列说法中正确的是( )
Z(g) ΔH<0,反应经60 s达到平衡并生成0.3 mol Z,则下列说法中正确的是( )
A. 其他条件不变,升高温度逆反应速率加快,正反应速率减慢
B. 其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的![]()
C. 其他条件不变,将容器体积缩小至5 L,平衡正向移动,平衡常数增大
D. 以Y浓度变化表示的反应速率为0.000 5 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数为NA,下列说法正确的是( )
A.1mol钠与足量氧气反应,生成氧化钠和过氧化钠的混合物,转移的电子数为NA
B.通常状况下,NA个CO2分子的体积是22.4L
C.100ml0.1mol/L的H2SO4溶液中H+的个数是0.2NA
D.若1gN2含有m个分子,则NA=m/28
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实或数据能说明次氯酸为弱电解质的是
A. 次氯酸具有漂白性 B. 常温时,次氯酸水溶液的pH < 7
C. 次氯酸不稳定,易分解 D. 0.001 molL-1 HClO溶液的pH = 5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com