
根据下列热化学方程式:①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol
②H2(g)+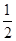 O2(g)===H2O(l) ΔH2=-285.8 kJ/mol
O2(g)===H2O(l) ΔH2=-285.8 kJ/mol
③CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH 3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为
| A.ΔH =+244.1 kJ/mol | B.ΔH =-488.3 kJ/mol |
| C.ΔH =-996.6 kJ/mol | D.ΔH =+996.6 kJ/mol |
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012届广东省高二上学期期末考试化学试卷卷 题型:选择题
根据下列热化学方程式
(1)C(s) + O2(g) = CO2(g) △H1=–393.5 kJ/mol
(2)H2(g)
+  O2(g)
= H2O(l)
△H2=–285.8 kJ/mol
O2(g)
= H2O(l)
△H2=–285.8 kJ/mol
(3)CH3COOH(l) +2O2(g)=2CO2 (g) + 2H2O(l) △H3=–870.3kJ/mol
可以计算出2C(s) + 2H2(g)+ O2(g)=CH3COOH(l)的反应热为:
A.△H=+244.1kJ/mol B.△H=-488.3kJ/mol
C.△H=-996.6kJ/mol D.△H=+996.6kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com