

 2C(g)在2L密闭容器中反应,0.5min内C的物质的量增加了0.6mol有关反应速率中正确的是 ( )
2C(g)在2L密闭容器中反应,0.5min内C的物质的量增加了0.6mol有关反应速率中正确的是 ( ) 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源:不详 题型:单选题
 2C(g)
2C(g)| A.9∶3∶4 | B.3∶1∶2 | C.2∶1∶3 | D.3∶2∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
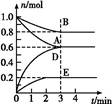
| 物质 | A | B | D | E |
| 物质的量(mol) | 0.8 | 1.0 | 0.4 | 0.2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4NO(g) + 6H2O(g),下列叙述正确的是
4NO(g) + 6H2O(g),下列叙述正确的是| A.达到化学平衡时,4v正(O2)=5v逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率增大,逆反应速率减小,平衡正向移动 |
| D.化学反应速率关系是:2v正(NH3)= 3v正(H2O) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 PCl3(g)+C12(g)
PCl3(g)+C12(g)  H=124kJ·mol-1。反应过程中测定的部分数据见下表:
H=124kJ·mol-1。反应过程中测定的部分数据见下表:| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCL3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N2(g)+2CO2(g) DH=-a kJ/mol(a>0)
N2(g)+2CO2(g) DH=-a kJ/mol(a>0)| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4 mol·L-1 | 10.0 | 4.05 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/10-3 mol·L-1 | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4NO+6H2O(g),在5L的密闭容器中进行半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率υ(x)(表示反应物的消耗速率或生成物的生成速率)为 ( )
4NO+6H2O(g),在5L的密闭容器中进行半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率υ(x)(表示反应物的消耗速率或生成物的生成速率)为 ( )| A.υ(O2)="0.001" mol·L-1·s-1 | B.υ(NO)="0.06" mol·L-1·s-1 |
| C.υ(H2O) ="0.003" mol·L-1·s-1 | D.υ(NH3)="0.001" mol·L-1·s-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定条件下,增加反应物的量,必定加快反应速率 |
| B.升高温度正反应速率增大,则逆反应速率也一定增大 |
| C.可逆反应的特征是正反应速率总是和逆反应速率相等 |
| D.使用催化剂一定会加快反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com