
(8分)在50 mL a mol/L的硝酸溶液中,加入6.4 g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO)=3 mol/L。
(1)求稀释后的溶液c(H+)= 。
(2)若a=9,则生成的气体中NO2的物质的量为 mol。
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
若将上述的NO2和NO的混合气体通入1 mol/L的NaOH恰好被吸收,NaOH溶液的体积为 mL。
(1)1 (2)0.125 (3)150
解析试题分析:(1)溶液中除了有H+、NO3-还有Cu2+,根据电荷守恒可知c(H+)+2c(Cu2+)= c(NO3-),所以c(H+)= 3-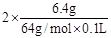 =1mol/L。
=1mol/L。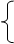
 (2)设NO2为xmol,NO为ymol,则 x+3y=
(2)设NO2为xmol,NO为ymol,则 x+3y=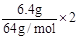 , 解得 x=0.125mol/L
, 解得 x=0.125mol/L
x+y=9×0.05-3×0.1 y=0.025mol/L
所以NO2的物质的量为0.125mol。
(3)根据原子守恒可知,N原子的量等于Na原子的量,所以NaOH为0.15mol,V(NaOH)=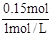 ="0.15L" =150mL。
="0.15L" =150mL。
考点:硝酸与金属反应计算
点评:硝酸与金属反应时,既表现出氧化性,又表现出酸性,根据守恒法计算比较简单。


科目:高中化学 来源:2015届黑龙江省高一上学期期末考试化学试卷(解析版) 题型:计算题
(8分)在50 mL a mol/L的硝酸溶液中,加入6.4 g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO)=3 mol/L。
(1)求稀释后的溶液c(H+)= 。
(2)若a=9,则生成的气体中NO2的物质的量为 mol。
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
若将上述的NO2和NO的混合气体通入1 mol/L的NaOH恰好被吸收,NaOH溶液的体积为 mL。
查看答案和解析>>
科目:高中化学 来源:2015届重庆市七校联盟高一上学期期中考试化学试卷(解析版) 题型:实验题
(8分)用98%的浓硫酸(其密度为1.84 g/cm3)配制100 mL 1.0 mol·L-1稀硫酸,若实验仪器有:
A 100 mL量筒 B玻璃棒 C 50 mL容量瓶 D 10 mL量筒
E 胶头滴管 F 50 mL烧杯 G 100 mL容量瓶
(1)需量取浓硫酸的体积为 mL,
(2)实验时不选用的仪器有(填序号) ,
(3)配制过程中,下列情况会使配制结果偏高的是(填序号) ,
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④浓硫酸在烧杯中稀释后未冷却到室温就转移到容量瓶中定容
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
D.将准确量取的18.4 mol·L-1的硫酸,注入已盛有30 mL水的100 mL的容量瓶中,加水至刻度线
查看答案和解析>>
科目:高中化学 来源:2014届云南省昆明市高二9月月考化学试卷(解析版) 题型:实验题
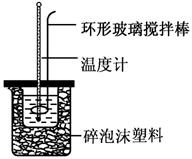
(共6分)实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
|
实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
|
|
盐酸 |
NaOH溶液 |
||
|
1 |
20.2 |
20.3 |
23.7 |
|
2 |
20.3 |
20.5 |
23.8 |
|
3 |
21.5 |
21.6 |
24.9 |
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 。
(2)在操作正确的前提下,提高中和热测定准确性的关键是 。
(3)根据上表中所测数据进行计算,则该实验测得的中和热ΔH= [盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将 (填“偏大”、“偏小”、 “不变”)。
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大
查看答案和解析>>
科目:高中化学 来源:2011-2012学年高考化学一轮复习《溶液中的离子反应》专题综合测试(苏教版) 题型:实验题
(8分)用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填编号字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用________(填编号字母)作指示剂。
A.甲基橙 B.石蕊
C.酚酞 D.甲基红
(3)滴定过程中,眼睛应注视______________;在铁架台上垫一张白纸,其目的是________________________________________________________________________
________________________________________________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是________mol·L-1,烧碱样品的纯度是________。
|
滴定次数 |
待测溶液 体积(mL) |
标准酸体积 |
|
|
滴定前的刻度 (mL) |
滴定后的刻度 (mL) |
||
|
第一次 |
10.00 |
0.40 |
20.50 |
|
第二次 |
10.00 |
4.10 |
24.00 |
(5)下列实验操作会对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
②若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com