
(1)实验室利用电石与水反应制备乙炔,请写出电石主要成分碳化钙的电子式: ;写出由乙炔制备聚氯乙烯的化学方程式: ; .
(2)写出由甲苯制备TNT的化学方程式: .
(3)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例). ; .
考点:
乙炔炔烃;化学方程式的书写;苯的同系物.
专题:
有机物的化学性质及推断.
分析:
(1)电石主要成分碳化钙,碳化钙为离子化合物,根据离子化合物电子式的书写方法来分析;乙炔与HCl发生加成反应生成氯乙烯,再发生加聚反应生成聚氯乙烯;
(2)甲苯在浓硫酸作用下可与浓硝酸反应生成TNT;
(3)苯的同系物含有1个苯环,侧链为烷基,一氯代物只有两种的物质,说明只含有2种环境的氢原子.
解答:
解:(1)电石主要成分碳化钙,碳化钙为离子化合物,其电子式为: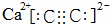 ;乙炔与HCl发生加成反应生成氯乙烯,再发生加聚反应,发生的反应为CH≡CH+HCl→CH2=CHCl,
;乙炔与HCl发生加成反应生成氯乙烯,再发生加聚反应,发生的反应为CH≡CH+HCl→CH2=CHCl,
CH2=CHCl发生加聚反应为nH2C=CHCl
 ,
,
故答案为: ;CH≡CH+HCl→CH2=CHCl;nH2C=CHCl
;CH≡CH+HCl→CH2=CHCl;nH2C=CHCl
 ;
;
(2)甲苯在浓硫酸作用下可与浓硝酸反应生成TNT,反应的化学方程式为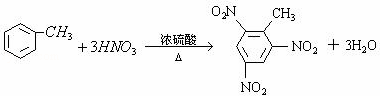 ,
,
故答案为: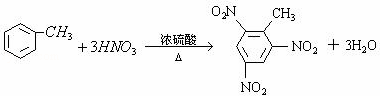 ;
;
(3)苯的同系物含有1个苯环,侧链为烷基,一氯代物只有两种的物质,说明只有2种环境的氢原子,则与苯互为同系物且一氯代物只有两种的物质的结构简式为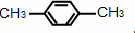 ,
,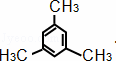 ;
;
故答案为: ;
; .
.
点评:
本题主要考查了电子式的书写、加成反应和加聚反应、甲苯的性质、同分异构体的判断等,题目难度不大,注意根据有机物的官能团来确定发生的反应.


科目:高中化学 来源: 题型:
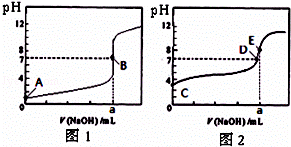
常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L 盐酸和20.00mL 0.1000mol/L 醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )
|
| A. | 滴定盐酸的曲线是图2 |
|
| B. | 达到B、D状态时,两溶液中离子浓度均为 c(Na+)=c(A﹣) |
|
| C. | 达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl) |
|
| D. | 当0 mL<V(NaOH)<20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为 c(A﹣)>c(Na+)>c(H+)>c(OH﹣) |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知,当羟基与双键碳原子相连接时,易发生如下转化:
化学式为C8H8O2的有机物有如下的转化关系:
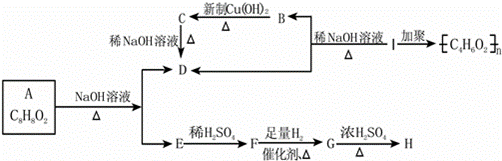 其中F能与FeCl3溶液显紫色,I为一种不饱和酯.
其中F能与FeCl3溶液显紫色,I为一种不饱和酯.
回答:(1)结构简式A ,I .
(2)写出反应类型:A→D+E ;F→G .
(3)写出下列反应的化学方程式①I→D+B .②B→D
(4)①与A具有相同官能团、且属于芳香族化合物的同分异构体有 种(不含A),其中不能发生银镜反应的结构简式:.
②在A的同分异构体中既属于酚又属于醛的有 种.
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物X、Y分子式不同,它们只含C、H、O元素中的两种或三种,若将X、Y不论何种比例混合,只要其物质的量之和不变,完全燃烧时消耗氧气的物质的量和生成二氧化碳的物质的量也不变.则X、Y可能是( )
|
| A. | CH2O、C3H6O2 | B. | C2H2、C6H6 | C. | C2H4、C2H6O | D. | C2H4、C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 分子式为CH4O和C2H6O的物质一定互为同系物 |
|
| B. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
|
| C. | 苯酚钠溶液中通入少量二氧化碳生成苯酚和碳酸钠 |
|
| D. | 2,3一二甲基丁烷的核磁共振氢谱中会出现两个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 凡是放热反应都是自发的,由于吸热反应都是非自发的 |
|
| B. | 自发反应一定是熵增大,非自发反应一定是熵减少或不变 |
|
| C. | 自发反应在恰当条件下才能实现 |
|
| D. | 自发反应在任何条件下都能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上通常用下列方法治理含氮化合物的污染。
(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。已知:
N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=—221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=—393. 5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式 。
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为 。
(3)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO 的原理如图1,A为电源的 极,阴极反应式为 。
的原理如图1,A为电源的 极,阴极反应式为 。


(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图2是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。
①相同条件下,Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是 ,
图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是 。
②由图可得Fe(OH)2的溶度积的值为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com