
【题目】良好生态环境是最普惠的民生福祉。治理大气污染物CO、NOX、SO2具有十分重要的意义。
(1)氧化还原法消除NOX的转化如下所示: 。反应I为NO+O3===NO2+O2,其还原产物是_________。反应Ⅱ中,氧化剂与还原剂的物质的量之比为__________。
。反应I为NO+O3===NO2+O2,其还原产物是_________。反应Ⅱ中,氧化剂与还原剂的物质的量之比为__________。
(2)吸收SO2和NO获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。

装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式_______________。装置III中发生反应的离子方程式为_________________。
(3)已知进入装置IV的溶液中NO2-的浓度为a mol·L-1,要使1L该溶液中NO2-完全转化为NH4NO3,至少需向装置IV中通入标准状况下的氧气____L(用含a代数式表示)。
【答案】NO2 3:2 2NO+3H2O+4Ce4+=NO3-+NO2-+6H++4Ce3+ 2Ce3++2H++2HSO3-![]() 2Ce4++S2O42-+2H2O 11.2aL
2Ce4++S2O42-+2H2O 11.2aL
【解析】
(1)根据反应NO+O3=NO2+O2可知:O3中部分氧元素由0价下降到-2价,而NO中氮元素的化合价升高,都转化为NO2,所以该反应中的还原产物和氧化产物都是NO2。反应Ⅱ中,氮元素最终转变为N2,N2既是氧化产物又是还原产物,NO2中氮元素由+4价降低到0价,被还原,CO(NH2)2中氮元素由-3价升高到0价,由得失电子数目守恒可得n(NO2)∶n[CO(NH2)2]=3∶2;
(2)NO被Ce4+氧化生成等物质的量的NO3-和NO2-,根据流程图可知Ce4+被还原为Ce3+,由氧化还原反应的规律分析可得离子反应:2NO+3H2O+4Ce4+=NO3-+NO2-+6H++4Ce3+;装置III为电解池,由流程图可知在装置中的反应物有Ce3+和HSO3-,生成物为Ce4+和S2O42-,然后结合离子反应的电荷守恒和质量守恒可得答案;
(3)溶液中的NO2-完全转化为NH4NO3,根据流程图可知装置Ⅳ中加入了氨气和氧气,因此NO2-被氧气氧化生成NO3-,氮元素化合价由+3价升高到+5价,氧气中氧元素由0价降低到-2价,由氧化还原反应中得失电子数目守恒可得关系式:2NO2-~O2,由此计算解答。
(1)根据反应NO+O3=NO2+O2可知:O3中部分氧元素由0价下降到-2价,生成了NO2,所以该反应中的还原产物为NO2;反应Ⅱ中,氮元素最终转变为N2,N2既是氧化产物又是还原产物,NO2中氮元素由+4价降低到0价,被还原,CO(NH2)2中氮元素由-3价升高到0价,被氧化,当n(NO2)∶n[CO(NH2)2]=3∶2时氧化还原反应中得失电子数目守恒,所以氧化剂和还原剂的物质的量之比为3:2,故答案为:NO2、3:2;
(2)NO被Ce4+氧化生成等物质的量的NO3-和NO2-,根据流程图可知Ce4+被还原为Ce3+,因此离子方程式为2NO+3H2O+4Ce4+=NO3-+NO2-+6H++4Ce3+;装置III为电解池,Ce3+失电子被氧化生成Ce4+,在电解槽中阳极上失电子,阳极反应式为:2Ce3+-2e-= 2Ce4+,根据流程图可知HSO3-参与反应,在阴极得电子,因此反应式为2H++2HSO3-+2e-=S2O42-+2H2O,则装置III中发生反应的离子方程式为2Ce3++2H++2HSO3-![]() 2Ce4++S2O42-+2H2O,故答案为:2NO+3H2O+4Ce4+=NO3-+NO2-+6H++4Ce3+;2Ce3++2H++2HSO3-
2Ce4++S2O42-+2H2O,故答案为:2NO+3H2O+4Ce4+=NO3-+NO2-+6H++4Ce3+;2Ce3++2H++2HSO3-![]() 2Ce4++S2O42-+2H2O;
2Ce4++S2O42-+2H2O;
(3)溶液中的NO2-完全转化为NH4NO3,根据流程图可知装置Ⅳ中加入了氨气和氧气,因此NO2-被氧气氧化生成NO3-,氮元素化合价由+3价升高到+5价,氧气中氧元素由0价降低到-2价,根据得失电子守恒可知两者反应的关系式为:2NO2-~O2,n(NO2-)=amol/L·1L=amol,则需氧气的物质的量为:n(NO2-)÷2=![]() mol,其标准状况下的体积为:
mol,其标准状况下的体积为:![]() mol×22.4L/mol=11.2aL,故答案为:11.2aL。
mol×22.4L/mol=11.2aL,故答案为:11.2aL。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质分类正确的是( )
A.硫酸、盐酸均为电解质B.Na2O2为碱性氧化物
C.NaOH、NH3H2O都为可溶性碱D.蛋白质溶液、液氯均属于分散系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨对工、农业生产和国防都有重要意义。 已知:N2(g)+3 H2(g)2NH3(g) △H= -92.4kJ/mol,请回答:
(1)合成氨工业中采取的下列措施可以用平衡移动原理解释的是________(填字母)。
a. 用铁触媒加快化学反应速率
b. 采用较高压强(20MPa~50MPa)
c. 采用较高温度(500℃左右)
d. 将生成的氨液化并及时从体系中分离出来
(2)一定温度下,在密闭容器中充入1mol N2和3mol H2并发生反应。
①若容器容积恒定,达到平衡时,N2的转化率α1 =25%,此时,反应放热______kJ,容器内气体压强与开始时气体压强之比是________。
②若容器压强恒定,则达到平衡时,容器中N2的转化率α2______α1(填“>”“<”或“=”)。
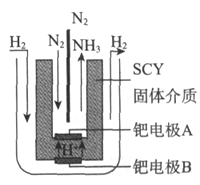
(3)随着对合成氨研究的发展,希腊科学家采用高质子导电性的SCY陶瓷(能传递![]() )为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图)。钯电极A为_________极(填“阴”或“阳”),该极上的电极反应式是_______。
)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图)。钯电极A为_________极(填“阴”或“阳”),该极上的电极反应式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水综合利用的工艺流程如图所示(粗盐中的可溶性杂质有MgC12、CaC12、Na2SO4)。下列说法错误的是

A. 步骤①加入试剂的顺序:水→NaOH溶液→Na2CO3溶液→BaC12溶液→过滤后加盐酸
B. 步骤②的操作是在氯化氢气流中加热MgC12·6H2O
C. 从步骤③到步骤⑤的目的是为了浓缩富集溴
D. 火力发电厂燃煤排放的含SO2的烟气经处理后可用在步骤④反应中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两种有机物的结构简式如下图所示,下列说法正确的是

A. 甲和乙均可以和氢氧化钠溶液反应
B. 有机物乙存在顺反异构
C. 乙分子中所有的碳原子一定在同一平面上
D. 甲和乙均能与溴水发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对饱和AgCl溶液(有AgCl固体存在)进行下列操作后,c(Ag+)和Ksp(AgCl)均保持不变的是
A.加少量水稀释B.加热
C.加入少量盐酸D.加入少量AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸(α﹣羟基丁二酸)是一种健康食品饮料,结构如图:
![]()
下列相关说法不正确的是
A. 苹果酸在铜或银作催化剂下,能与氧气反应
B. 苹果酸在一定条件下能形成环状有机化合物
C. 苹果酸在氢氧化钠的乙醇溶液中加热,能发生消去反应
D. 苹果酸能发生缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐中含有Mg2+,Ca2+,SO42-等离子,现进行粗盐的提纯,需将这些离子都除去,需要用到的试剂有如下几种:①BaCl2溶液②Na2CO3溶液③NaOH溶液④稀盐酸,则添加的正确顺序是
A.①②③④B.④①③②C.②③④①D.①④②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com