
【题目】已知胆矾溶于水时溶液温度降低,室温下将1 mol无色硫酸铜制成溶液时放出热量为Q1,又知胆矾分解的热化学方程式为CuSO4·5H2O(s) ![]() CuSO4(s)+5H2O(l) ΔH=+Q2,则Q1和Q2的关系为
CuSO4(s)+5H2O(l) ΔH=+Q2,则Q1和Q2的关系为
A.Q1<Q2 B.Q1>Q2 C.Q1=Q2 D.无法确定
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 在化学反应过程中,发生物质变化的同时不一定发生能量变化
B. 生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应
C. 反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0
D. ΔH的大小与热化学方程式的计量系数无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2具有强氧化性,可以用来漂白纺织类物品、麦杆、纤维等。
(1)Na2O2中O元素的化合价为__________。
(2)如图所示实验,滴入几滴水,现象是,反应的化学方程式为。实验结束后,向试管所得溶液中滴加酚酞溶液,现象是_______________________。
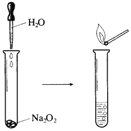
(3)若用嘴通过导管向附着少量Na2O2粉末的棉花吹气,棉花燃烧。原因是___________________Na2O2与H2O、CO2反应,其中与CO2反应的化学方程式为__________________。若标准状况下反应生成了5.6LO2,则转移电子的物质的量为_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是
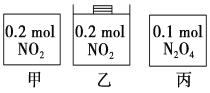
A.平衡时各容器内c(NO2)的大小顺序为乙>甲>丙
B.平衡时N2O4的百分含量:乙>甲=丙
C.平衡时甲中NO2与丙中N2O4的转化率相同
D.平衡时混合物的平均相对分子质量:甲>乙>丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C5H7Cl的有机物,其结构不可能的是( )
A. 只含有1个双键的直链有机物
B. 含有2个双键的直链有机物
C. 含有1个双键的环状有机物
D. 含1个叁键的直链有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是( )
A.锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu
B.氢氧化钠溶液与盐酸反应:OH﹣+H+═H2O
C.铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑
D.氯化钡溶液与稀硫酸反应:Ba2++SO42﹣═BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水。
阳离子 | Na+ | Al3+ | Fe3+ | Cu2+ | Ba2+ |
阴离子 | OH- | Cl- | CO32- | NO3- | SO42- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4 g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6 mol/L稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
(1)据此推断A的化学式为:A ;B ;
(2)写出过量C与D发生反应的离子方程式 。
(3)B溶液中滴入石蕊试液,现象是 ,原因是 (用离子方程式说明)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:

(1)步骤③的离子方程式:_________________________________。
(2)步骤⑤中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是________。
(3)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过________(填试剂名称)溶液,以除去氯气。
(4)步骤⑤的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因:___________________________。
(5)步骤①中用硫酸酸化可提高Cl2的利用率,理由是_______________________。
(6)提取溴单质,采用蒸馏“溴水混合物Ⅱ”而不是蒸馏“溴水混合物Ⅰ”,请说明原因:
______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,相同物质的量浓度的下列溶液:①NaCl;②NaOH;③H2SO4;④(NH4)2SO4,其中水的电离程度按由大到小顺序排列的一组是( )
A.④>③>②>① B.②>③>①>④ C.③>②>①>④ D.④>①>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com