
下列物质不能通过化合反应直接制得的是( )
A. FeCl2 B. NaHSO3 C. Cu(OH)2 D. Na2O2
考点: 铜金属及其重要化合物的主要性质;钠的重要化合物;铁盐和亚铁盐的相互转变.
分析: A.铁与氯化铁反应生成氯化亚铁;
B.亚硫酸钠与二氧化硫、水反应生成亚硫酸氢钠;
C.氧化铜与水不反应,不能生成氢氧化铜;
D.钠与氧气在加热条件下生成过氧化钠.
解答: 解:A.Fe+2FeCl3=3FeCl2,所以能通过化合反应制得,故A不选;
B.Na2SO3+H2O+CO2=2NaHSO3,所以能通过化合反应制得,故B不选;
C.氧化铜与水不反应,不能够通过化合反应制取氢氧化铜,故C选;
D.2Na+O2 Na2O2,所以能够通过化合反应制得,故D不选;
Na2O2,所以能够通过化合反应制得,故D不选;
故选:C.
点评: 本题综合考查元素化合物知识,明确物质的性质是解本题关键,注意常见物质的性质以及反应类型的判断,题目难度不大.


科目:高中化学 来源: 题型:
在实验室中,下列除去杂质的方法正确的是( )
①乙烷中混乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏;
⑤溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出溴;
⑥硝基苯中混有浓HNO3和浓H2SO4,将其倒入NaOH溶液中,静置后再过滤。
A.①②③⑥ B.②④ C.②③④ D.②③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
钛(Ti)因为具有神奇的性能越来越引起人们的关注。常温下钛不和非金属、强酸反应。红热时,却可与常见的非金属单质反应。钛是航空、军工、电力等方面的必需原料。地壳中含钛矿石之一是金红石(TiO2),目前大规模生产钛的方法是:第一步:金红石、碳粉混合,在高温条件下通入Cl2制得TiCl4和一种可燃性气体,该反应的化学方程式为______________________________,该反应的还原剂是________。
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。
(1)写出此反应的化学方程式:_____________________________________________。
(2)简述从上述所得产物中获取金属钛的步骤___________________________ _______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系: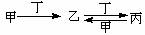 。下列有关物质的推断不正确的是( )
。下列有关物质的推断不正确的是( )
A.若甲为焦炭,则丁可能是O2 B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是盐酸 D.若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠(NaNO2)的装置如下图所示(部分夹持装置略)。
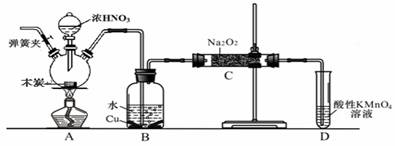
已知:室温下,①2NO+Na2O2 = 2NaNO2
②3NaNO2+3HCl == 3NaCl+HNO3+2NO↑+H2O
③酸性条件下,NO或NO2– 都能与MnO4–反应生成NO3– 和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式 。
(2) B中观察到的主要现象是有无色气体产生和 ,写出有关反应的离子方程式 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的方法是 。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称 。
(5)将1.56g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数的值.下列叙述正确的组合是( )
①14g乙烯和丙烯的混合物中氢原子数为2NA个
②0.1mol•L﹣1的FeCl3溶液滴入沸水形成的胶体粒子的数目为0.1NA个
③标准状况下,2.24L Cl2通入足量的NaOH溶液中转移的电子数为0.1NA个
④25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH﹣ 数目为0.2NA个
⑤常温下,100mL 1mol•L﹣1Na2CO3溶液中阴离子总数大于0.1NA个
⑥1mol Na2O2与足量水蒸气反应转移电子数为NA个
⑦常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA个.
A.①④⑤⑦ B. ②⑤⑥⑦ C. ①③⑤⑥ D. ①③⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
98%的浓硫酸(密度为1.84g•cm﹣3)配制0.5mol•L﹣1的稀硫酸180mL,现给出下列仪器(配制过程中可能用到):①50mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤250mL容量瓶;⑥胶头滴管;⑦玻璃棒.配置过程一定需要使用的仪器是( )
|
| A. | ②③⑤⑥⑦ | B. | ③④⑤⑥⑦ | C. | ①②③⑤⑥⑦ | D. | ①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:H2(g)+F2(g)===2HF(g) 的能量变化如图所示,下列有关叙述中正确的是
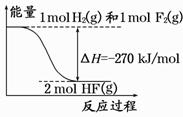
A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.断裂1 mol H—H键和1 mol F—F 键放出的能量大于形成2 mol H—F键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
下列鉴别方法不可行的是
A.用水鉴别乙醇、甲苯和溴苯
B.用酸性高锰酸钾溶液鉴别苯、环已烯和环已烷
C.用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
D.用燃烧法鉴别乙醇、苯和四氯化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com