
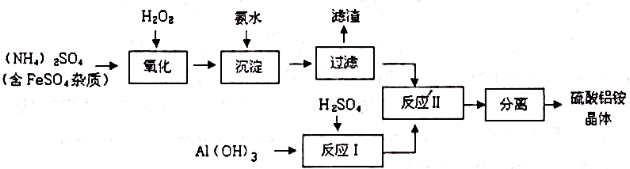

分析 由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,过滤后滤液主要含硫酸铵,氢氧化铝与硫酸混合反应生成硫酸铝溶液,再将硫酸铵和硫酸铝溶液混合反应,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等最终得到硫酸铝铵晶体,
(1)由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,
(2)过滤后的滤液中可能含有Fe3+,用KSCN溶液检验是否含有Fe3+;
(3)由工艺流程可知,流程中“分离”是从溶液中获得晶体,操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥等;
(4)硫酸铝铵晶体的化学式为Al2(NH4)4(S04)n•24H20,相对分子质量为906,则4.53g硫酸铝铵晶体的物质的量为0.02mol,根据铝元素守恒,Al2O3的物质的量为0.02mol,据此计算.
解答 解:由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,过滤后滤液主要含硫酸铵,氢氧化铝与硫酸混合反应生成硫酸铝溶液,再将硫酸铵和硫酸铝溶液混合反应,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等最终得到硫酸铝铵晶体;
(1)①由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,
故答案为:Fe(OH)3;
(2)过滤后的滤液中可能含有Fe3+,取少许滤液于试管中,加几滴KSCN溶液,若溶液不变红色,则杂质已除尽.
故答案为:KSCN溶液;
(3)由工艺流程可知,流程中“分离”是从溶液中获得晶体,操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥等,
故答案为:冷却结晶;
(4)硫酸铝铵晶体的化学式为Al2(NH4)4(S04)n•24H20,相对分子质量为906,则4.53g硫酸铝铵晶体的物质的量为0.02mol,根据铝元素守恒,Al2O3的物质的量为0.02mol,所以所得氧化铝的质量为0.02×102g=2.04g,
故答案为:2.04g.
点评 本题考查镁铝及其化合物的性质,对工艺流程理解、常用化学用语、盐类水解、物质的分离提纯与离子检验、化学计算等,综合性较大,难度较高,需要学生具备扎实的基础与运用知识分析解决问题的能力.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| C. | 蛋白质、油脂、纤维素都是高分子化合物 | |
| D. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在豆浆里加入盐卤做豆腐 | |
| B. | 在河流入海处易形成沙洲 | |
| C. | 三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 | |
| D. | 用一支钢笔使用不同品牌墨水时,容易发生堵塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在工业中利用镁制取硅:2Mg+SiO22MgO+Si,同时有副反应发生:2Mg+SiMg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体.如图是进行Mg与SiO2反应的实验装置:
在工业中利用镁制取硅:2Mg+SiO22MgO+Si,同时有副反应发生:2Mg+SiMg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体.如图是进行Mg与SiO2反应的实验装置:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 装置 | 目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸及其钠盐可用作乳胶、牙膏、果酱及其它食品的防腐剂,也可用作染色和印色的媒染剂.某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸,制备原理如图1和实验主要装置如图2:
苯甲酸及其钠盐可用作乳胶、牙膏、果酱及其它食品的防腐剂,也可用作染色和印色的媒染剂.某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸,制备原理如图1和实验主要装置如图2:| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉就会溶解 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 | |
| C. | 白纸上滴加浓硫酸后变黑体现了浓硫酸的吸水性 | |
| D. | HNO3→NO→NO2,以上各步变化均能通过一步实验完成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com