
【题目】N2O、NO和NO2等氮氧化物是空气污染物含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为___。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收。
①下列措施不能提高尾气中NO和NO2去除率的有___(填字母代号)
A.采用气、液逆流的方式吸收尾气
B.加快通入尾气的速率
C.吸收尾气过程中定补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是__(填化学式),吸收后排放的尾气中含量较高的氮氧化物是__(填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
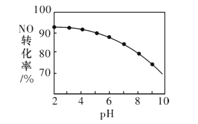
①在酸性NaClO溶液中,HC1O氧化NO生成Cl和NO3-,其离子方程式为__。
②NaClO溶液的初始pH越小,NO转化率越高,其原因是__。
【答案】2NH3+2O2![]() N2O+3H2O B NaNO3 NO 3HClO+2NO+H2O=3C1+2NO3-+5H+ 溶液pH越小溶液中HClO的浓度越大氧化NO的能力越强
N2O+3H2O B NaNO3 NO 3HClO+2NO+H2O=3C1+2NO3-+5H+ 溶液pH越小溶液中HClO的浓度越大氧化NO的能力越强
【解析】
(1)NH3与O2在加热和催化剂作用下生成N2O,类似于生成NO的反应,同时生成水;
(2)①提高尾气中NO和NO2去除率,应是气体与氢氧化钠溶液充分接触而反应;
②反应生成NaNO2和NaNO3;如NO的含量比NO2大,则尾气中含有NO;
(3)①在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO3-,反应后溶液呈酸性;
②NaClO溶液的初始pH越小,HClO的浓度越大,氧化能力强。
(1)NH3与O2在加热和催化剂作用下生成N2O和水,反应的化学方程式为2NH3+2O2![]() N2O+3H2O;故答案为:2NH3+2O2
N2O+3H2O;故答案为:2NH3+2O2![]() N2O+3H2O;
N2O+3H2O;
(2)①A.采用气、液逆流的方式吸收尾气,可使气体与氢氧化钠溶液充分反应,可以提高尾气中NO和NO2去除率,故A不选;
B.加快通入尾气的速率,气体不能充分反应,不能提高尾气中NO和NO2去除率,故B选;
C.吸收尾气过程中定期补加适量NaOH溶液,可使气体充分反应,可以提高尾气中NO和NO2去除率,故C不选;故答案为B;
②反应生成NaNO2和NaNO3,则含有的杂质为NaNO3,如NO的含量比NO2大,则尾气中含有NO,故答案为:NaNO3;NO;
(3)①在酸性NaClO溶液中,HClO氧化NO生成Cl和NO3,反应后溶液呈酸性,则反应的离子方程式为3HClO+2NO+H2O=3C1+2NO3-+5H+;
②NaClO溶液的初始pH越小,HClO的浓度越大,氧化能力强,则提高NO转化率,故答案为:3HClO+2NO+H2O=3C1+2NO3-+5H+;溶液pH越小,溶液中HClO的浓度越大,氧化NO的能力越强。


科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定过程中,眼睛应注视________________。滴定时,用0.2000molL-的盐酸来滴定待测液,不可选用______(填编号字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定时,用0.200 0 mol·L-1的盐酸来滴定待测溶液,根据下表数据,计算被测烧碱溶液的物质的量浓度是________ mol·L-1,烧碱样品的纯度是________。
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(4)下列实验操作会对滴定结果产生什么后果?(填“偏高”、“偏低”或“无影响”)
①若将锥形瓶用待测液润洗,然后加入10.00mL待测液,则滴定结果______
②若锥形瓶未干燥就加入10.00mL待测液,则滴定结果______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为减少交通事故,新交规明令禁止酒后驾车并对酒后驾车行为予以重罚。为检验驾驶员是否酒后驾车,可采用的检验方法有多种。回答以下问题:
(1)早期曾经采用五氧化二碘和某种高分子化合物X的混合溶液来检测酒精的存在。理是:I2O5与CH3CH2OH先发生反应(I2O5+5CH3CH2OH=I2+5Y+5H2O),生成的I2与高分子化合物X作用而变蓝。交警依据此原理来检测驾驶员是否饮酒。则:X的化学式是_____________;Y的化学式是_________;
(2)已知:I2O5是白色固体,可用于检验并定量测定空气中CO;两者在常温条件下发生的反应为5CO+I2O5=5CO2+I2(空气中其余气体不与I2O5反应);某同学设计如图实验装置完成上述目的。
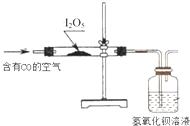
①指出能证明空气中有CO存在的现象:_____________。
②将上述反应生成的碘单质用硫代硫酸钠滴定(反应为I2+2Na2S2O3=Na2S4O6+2NaI),即可根据消耗硫代硫酸钠的量来计算空气中CO的含量。若某次实验时测得参与反应的空气体积为a mL(标准状况下),滴定过程中,共消耗vmLcmol·L﹣1Na2S2O3溶液,则该空气样品中CO的体积分数是________。
③有同学提出只要依据参与反应的空气体积和洗气瓶中白色沉淀的质量也可求得空气中CO。此方案是否可行?_________。
(3)燃料电池酒精检测仪(该电池以硫酸溶液为电解质溶液)也是检测酒精含量的一种方法。总反应是:CH3CH2OH+O2=CH3COOH+H2O。该电池负极电极反应式是________________。
(4)酒精是一种较为环保的燃料,298K时,1g乙醇完全燃烧放出热量qkJ,写出乙醇燃烧的热化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据题意,选择恰当的选项用字母代号或文字填空。
(1)中国的高铁技术居于国际领先地位。
①高铁座椅内填充有聚氨酯软质泡沫。聚氨酯属于___(填字母代号,下同)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
②高铁信息传输系统中使用了光导纤维。光导纤维的主要成分是___。
a.铜 b.石墨 c.二氧化硅
③高铁轨道建设需用大量水泥。生产水泥的主要原料为黏土和___。
a.石灰石 b.粗盐 c.纯碱
④高铁轨道建设铺设的铁轨属于___(填“金属铁”或“铁合金”)。
(2)煤炭在我国能源结构中占有重要地位,合理使用有利于社会可持续发展。
①控制燃煤产生的___(填化学式)排放,能够减少硫酸型酸雨的形成。
②煤的气化和液化是实现能源清洁化的重要途径。水煤气中CO和H2在加热、加压和催化剂存在条件下可以合成液体燃料(CH3OH),该反应的化学方程式为___。煤的干馏属于__(填“化学变化”或“物理变化”)。
(3)营养均衡有利于身体健康。
①人体内提供能量的主要营养物质为___、糖类和蛋白质。
②维生素是人体需要的营养物质。如图为某品牌维生素C泡腾片说明书的部分内容。该泡腾片中添加的着色剂是___。

③泡腾片溶于水时产生“沸腾”效果,是由于添加的酒石酸和___(填物质名称)反应释放出了气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中所示的装置图能够达到实验目的是( )
A. 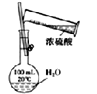 配制一定浓度的稀硫酸
配制一定浓度的稀硫酸
B. 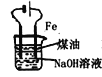 实验室制备Fe(OH)2
实验室制备Fe(OH)2
C. 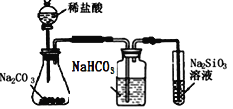 比较氯、碳、硅三种元素的非金属性强弱
比较氯、碳、硅三种元素的非金属性强弱
D.  加热熔融NaOH固体
加热熔融NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此,下列说法正确的是

A.该硫酸的物质的量浓度为9.2mol·L-1
B.该硫酸与等体积的水混合所得溶液的质量分数小于49%
C.配制200mL4.6mol·L-1的稀硫酸需取该硫酸50.0mL
D.该硫酸50.0mL与足量的铜反应可得到标准状况下SO2气体10.304L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产与人类进步紧密相联。下列有关说法不正确的是
A. 空气吹出法提取海水中溴通常使用SO2作还原剂
B. 侯氏制碱法工艺流程中利用了物质溶解度的差异
C. 合成氨采用高温、高压和催化剂主要是提高氢气平衡转化率
D. 工业用乙烯直接氧化法制环氧乙烷体现绿色化学和原子经济
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异丁烯(![]() )是重要的化工原料,主要用于制备丁基橡胶、聚异丁烯塑料等。下列关于异丁烯的说法错误的是( )
)是重要的化工原料,主要用于制备丁基橡胶、聚异丁烯塑料等。下列关于异丁烯的说法错误的是( )
A.异丁烯发生加聚反应生成聚异丁烯
B.异丁烯在一定条件下可以和氢气发生加成反应,加成产物的二氯代物有3种
C.异丁烯与HCl在一定条件下能发生加成反应且只能得到一种加成产物
D.异丁烯和环丁烷(![]() )互为同分异构体
)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某厂生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应方程式为2CH3OH+3O2=2CO2+4H2O。下列说法中正确的是( )

A.左边的电极为电池的正极,a处通入的是甲醇
B.右边的电极为电池的负极,b处通入的是空气
C.电池的负极反应式为CH3OH+H2O-6e-=CO2+6H+
D.电池的正极反应式为O2+2H2O+4e-=4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com