
【题目】下列物质所配成的0.1 mol/L溶液中,离子浓度由大到小顺序排列正确的( )
A. NH4Cl:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
B. Na2CO3:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
C. NaHCO3:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
D. ( NH4)2SO4:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
【答案】D
【解析】A项,氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,NH4++H2O![]() NH3·H2O+H+,所以c(H+)>c(OH-),铵根离子水解而氯离子不水解,所以c(Cl-)>c(NH4+),因为铵根离子水解程度是微弱的,所以 c(NH4+)>c(H+),因此NH4Cl溶液中离子浓度的大小顺序是:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故A错误;B项,在Na2CO3溶液中,碳酸根离子部分水解,溶液呈碱性,所以c(OH-)>c(H+),又因为钠离子不水解,所以c(Na+)>c(CO32-),因为碳酸根离子水解程度是微弱的,所以c(CO32-)>c(HCO3-),根据碳酸根离子的两步水解反应方程式:CO32-+H2O
NH3·H2O+H+,所以c(H+)>c(OH-),铵根离子水解而氯离子不水解,所以c(Cl-)>c(NH4+),因为铵根离子水解程度是微弱的,所以 c(NH4+)>c(H+),因此NH4Cl溶液中离子浓度的大小顺序是:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故A错误;B项,在Na2CO3溶液中,碳酸根离子部分水解,溶液呈碱性,所以c(OH-)>c(H+),又因为钠离子不水解,所以c(Na+)>c(CO32-),因为碳酸根离子水解程度是微弱的,所以c(CO32-)>c(HCO3-),根据碳酸根离子的两步水解反应方程式:CO32-+H2O![]() HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O![]() H2CO3+OH-,因第一步水解生成的HCO3-离子还要发生第二步水解,造成HCO3-浓度减小而OH-浓度增加,再加上水电离出的OH-,所以c(OH-)>c(HCO3-),综上所述,在Na2CO3溶液中,离子浓度的大小顺序是:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故B错误;C项,在NaHCO3溶液中,HCO3-仅有少量电离,所以溶液中c(HCO3-)>c(CO32-),故C错误;D项,在( NH4)2SO4溶液中,铵根离子部分水解,溶液显酸性,则c(H+)>c(OH-),又因为水解程度微弱,所以c(NH4+)>c(SO42-),则溶液中离子浓度大小顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-),所以D正确。此题答案选D。
H2CO3+OH-,因第一步水解生成的HCO3-离子还要发生第二步水解,造成HCO3-浓度减小而OH-浓度增加,再加上水电离出的OH-,所以c(OH-)>c(HCO3-),综上所述,在Na2CO3溶液中,离子浓度的大小顺序是:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故B错误;C项,在NaHCO3溶液中,HCO3-仅有少量电离,所以溶液中c(HCO3-)>c(CO32-),故C错误;D项,在( NH4)2SO4溶液中,铵根离子部分水解,溶液显酸性,则c(H+)>c(OH-),又因为水解程度微弱,所以c(NH4+)>c(SO42-),则溶液中离子浓度大小顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-),所以D正确。此题答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是
A.SO2、SiO2、CO均为酸性氧化物B.多肽、油脂、淀粉均为酯类
C.烧碱、冰醋酸、四氯化碳均为电解质D.福尔马林、漂粉精、氨水均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学校实验室从化学试剂商店买回18.4molL﹣1的硫酸.现用该浓硫酸配制100mL 1molL﹣1的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有(选填序号),还缺少的仪器有(写仪器名称).
(2)配制100mL 1molL﹣1的稀硫酸需要用量筒量取上述浓硫酸的体积为mL(保留一位小数),量取浓硫酸时应选用(选填①10mL、②50mL、③100mL)规格的量筒.
(3)实验中造成所配溶液浓度偏高的原因可能是 .
A.容量瓶中原来含有少量蒸馏水
B.未经冷却,立即转移至容量瓶并洗涤烧杯,定容
C.烧杯没有洗涤
D.向容量瓶中加水定容时眼睛一直仰视刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质的量浓度相等的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液的pH随时间t变化的曲线如图所示,则下列说法中不正确的是
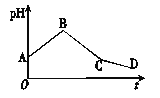
A. A点pH小于7是因为Cu2+水解使溶液显酸性
B. C点的pH比A点的pH小
C. BC段阳极产物是H2
D. CD段电解的物质是H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏伽德罗曾做过这样一个实验:“一抽空的密闭容器重M g,在标准状况下,盛满以相同物质的量混合的NO和H2的混合气体后,称量为(M+Q) g.把混合气体排尽,再充满SO2气体,为使天平平衡,应在托盘天平的__________边托盘上放置__________ g砝码…”横线上分别应填的是( )
A.右 (M+2Q)
B.右 (M+4Q)
C.左 (M+2Q)
D.左 (M+4Q)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“化学计量在实验中的应用”的相关知识填空.
(1)含有6.02×1023个氧原子的H2SO4的物质的量是 .
(2)与标准状况下V LCO2所含氧原子数目相同的水的质量是g(用分式表示)
(3)将4g NaOH溶解在10mL水中,再稀释成1L,从中取出10mL,这10mL溶液的物质的量浓度为 .
(4)在一定的温度和压强下,1体积X2(g)跟3体积Y2(g)化合生成2体积化合物,则该化合物的化学式是 .
(5)将50mL 0.1molL﹣1 NaCl和50mL 0.5molL﹣1 CaCl2 溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c(Cl ﹣)为 .
(6)三种正盐的混合溶液中含有0.2mol Na+、0.25mol Mg2+、0.4mol Cl﹣和SO42﹣ , 则n(SO42﹣)为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将4g的NaOH溶于一定质量的水中,若要使溶液中H2O与 NaOH的物质的量之比为20:1,试求算:
①满足条件要求所需要的水的质量为g.
②若所配溶液和1mol/L 的H2SO4溶液恰好完全中和,则反应所消耗的H2SO4的体积为mL.
③若测得该溶液的密度为1.1g/cm3 , 则该溶液体积为mL(小数点后保留一位有效数字),同时可知溶液中钠离子的浓度c(Na+)为mol/L(小数点后保留两位有效数字).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com