
【题目】为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图中夹持装置均已略去)。

[实验操作]
① 检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气发生。在F出口处收集氢气并检验其纯度。
② 关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③ 用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
(1)检验氢气纯度的目的是 。
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是 ,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是 ,C瓶内气体的成份是 。
(3)在步骤③中,先加热铁触媒的原因是 。反应管E中发生反应的化学方程式是 。
【答案】(1)“排除空气,保证安全”或“判断装置中空气是否排净,保证安全”(合理即可)
(2)锌粒与酸脱离 尽量增大氢气的浓度以提高氮气的转化率 N2 H2
(3)升高温度,增大铁触媒活性,加快氨的合成反应速率 N2+3H2![]() 2NH3
2NH3
【解析】
试题分析:(1)氢气和空气混合气体受热易爆炸。若不检验氢气的纯度可能在E处发生危险。(2)A装置原理类似启普发生器当试管内压强过大酸会流回长颈漏斗中使反应停止。C瓶利用排水法收集氢气氢气收集满后再通入气体压强变大导致A中酸流回漏斗和锌粒脱离接触反应停止。C中原有空气里的氧气被氢气燃烧而消耗最终主要剩余氮气,所以C中气体主要成分为氮气和氢气。通氢气一直到压强增大到不能增大为止可以让通入的氢气尽可能多。根据化学平衡原理增大氢气浓度可以提高氮气的转化率。(3)铁触媒在较高温度时活性增大加快氨合成的反应速率。发生的反应为: N2+3H2![]() 2NH3。
2NH3。


科目:高中化学 来源: 题型:
【题目】把NaOH和Na2CO3混和物配制成100mL溶液,其中c(Na+)=0.5mol/L。在该溶液中加入过量盐酸反应完全后,将溶液蒸干后所得固体质量约为
A、2.93 g B、5.85 g C、6.56g D、无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属的说法中不正确的是( )
A. 合金比纯金属具有较好的性能,一般情况下,硬度比纯金属高,熔点比纯金属的低
B. 合金仍然具有金属特性
C. 常用电解法冶炼钠、镁、铝等活泼金属
D. 将钢闸门与电源正极相连,可防止其在海水中被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示。回答下列问题:
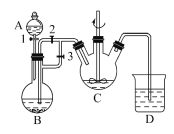
(1)A装置的名称是____________;FeCO3在________中生成(填字母),该装置中发生的主要反应的离子方程式为____________________。
(2)实验时首先打开活塞3,关闭活塞2,其目的是___________________;然后再关闭活塞3,打开活塞2,其目的是_____________________。
Ⅱ.乳酸亚铁晶体([CH3CH(OH)COO]2Fe·3H2O,Mr=288)是常用的补铁剂。乳酸亚铁可由乳酸与碳酸亚铁反应制得。
(3)将制得的FeCO3加入乳酸溶液中,再加入过量铁粉,75℃下搅拌使之充分反应。结束后,无需过滤,除去过量铁粉的反应方程式为_____________。
(4)从上述(3)所得溶液中获得乳酸亚铁晶体的方法是___________________、___________________、洗涤、干燥。
(5)该兴趣小组用KMnO4测定产品中亚铁含量进而计算乳酸亚铁晶体的质量分数,发现产品的质量分数总是大于100%,其原因可能是_______________。经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880 g产品配成100 mL溶液,每次取20.00 mL,进行必要处理,用0.100 0 mol·L-1Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)219.7 mL。滴定反应为Ce4++Fe2+====Ce3++Fe3+,则产品中乳酸亚铁晶体的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将氨水与氯化铵溶液混合得到c(NH3·H2O)+c(NH4+)=0.1 mol·L-1的混合溶液。溶液中c(NH3·H2O)、c(NH4+)与pH的关系如图所示。下列有关离子浓度关系叙述一定正确的是( ) 
A.W点表示溶液中:c(NH4+)+c(H+)=c(OH-)
B.pH=10.5溶液中:c(Cl-)+c(OH-)+c(NH3·H2O)<0.1 mol·L-1
C.pH=9.5溶液中:c(NH3·H2O)>c(NH4+)>c(OH-)>c(H+)
D.向W点所表示的1 L溶液中加入0.05 mol NaOH固体(忽略溶液体积变化):c(Cl-)>c(Na+)>c(OH-)>c(N H4+)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )

A.t℃时,Ag2CrO4的Ksp为1×10-8
B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.t℃时,Y点和Z点时Ag2CrO4的Ksp相等
D.t℃时,将0.01 mol·L-1AgNO3溶液滴入20 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com