
分析 浓硫酸增重为水的质量,碱石灰增重为二氧化碳的质量,根据质量守恒计算CO的质量,再根据原子守恒计算分子中C、H、O原子物质的量,进而确定有机物最简式,若最简式中H原子已经饱和碳的四价结构,则最简式即为分子式,否则需要知道相对分子质量确定分子式.
解答 解:(1)n(O2)=$\frac{2.8L}{{22.4g•mo{l^{-1}}}}$=0.125 mol,则 m(O2)=0.125 mol×32g•mol-1=4 g,
故m(CO)=4 g+2.3 g-2.7 g-2.2 g=1.4 g,
n(CO)=$\frac{1.4g}{{28g•mo{l^{-1}}}}$=0.05 mol,
n(H2O)=$\frac{2.7g}{{18g•mo{l^{-1}}}}$=0.15 mol,
n(CO2)=$\frac{2.2g}{{44g•mo{l^{-1}}}}$=0.05 mol,
则n(H)=2n(H2O)=0.15 mol×2=0.3 mol
n(C)=n(CO2)+n(CO)=0.05 mol+0.05 mol=0.1 mol
答:2.3 g A中所含氢原子、碳原子的物质的量分别为0.3 mol 和0.1 mol.
(2)2.3 g A中所含氧原子:n(O)=(0.05 mol×2+0.05 mol+0.15 mol)-0.125 mol×2=0.05 mol,
n(C):n(H):n(O)=0.1 mol:0.3 mol:0.05 mol=2:6:1
则A的最简式为 C2H6O,根据价键规则A的分子式为 C2H6O,
答:A 的分子式为 C2H6O.
点评 本题考查有机物分子式的确定,掌握燃烧法利用原子守恒确定最简式,再结合相对分子质量确定有机物分子式,注意最简式中H原子已经饱和碳的四价结构,则最简式即为分子式.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 44.8L | B. | 5L | C. | 11.2L | D. | 33.6L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
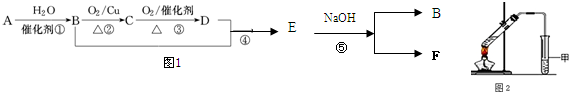
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

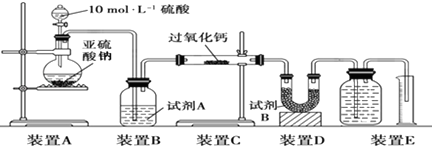
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4 溶液、Fe2(SO4)3溶液、大烧杯、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱.
现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4 溶液、Fe2(SO4)3溶液、大烧杯、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-和OH-向阳极定向运动,Cl-被电解,而OH-留在阳极,因此阳极区显碱性 | |
| B. | 阴极的电极反应是:4OH--4e-═O2↑+2H2O | |
| C. | 电解槽内总反应方程式为:2Cl-+2H2O═Cl2↑+H2↑+2OH- | |
| D. | 向阴阳极分别滴入2滴酚酞,现象是阴极区变成红色,阳极区不变色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 阳离子 | K+、Ag+、Mg2+、Ba2+ |
| 阴离子 | NO3-、CO32-、SiO32-、SO42- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 想该溶液中加入足量稀盐酸 | 生成白色沉淀并在标准状况下放出0.56L气体 |
| Ⅱ | 将Ⅰ中产生的混合液过滤,将沉淀洗涤、灼烧至恒重,称量所得固体的质量 | 固体质量为2.4g |
| Ⅲ | 向Ⅱ中所得的滤液中滴加BaCl2溶液 | 无明显现象 |
| 阴离子 | NO3- | CO32- | SiO32- | SO42- |
| c/mol•L-1 | ? | 0.25mol/L | 0.4mol/L | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com