钡盐生产中排出大量的钡泥[主要含BaCO
3、BaSO
3、Ba(FeO
2)
2等],某主要生产BaCO
3的化工厂利用钡泥制取Ba(NO
3)
2晶体及其他副产物,其部分工艺流程如下:
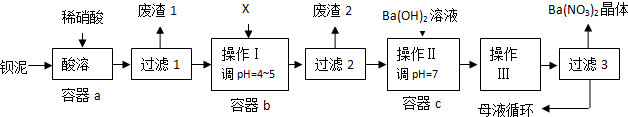
已知:①Fe(OH)
3和Fe(OH)
2完全沉淀时,溶液的pH分别为3.2和9.7
②Ba(NO
3)
2在热水中溶解度较大,在冷水中溶解度较小
③K
SP(BaSO
4)=1.1×10
-10,K
SP (BaCO
3)=5.1×10
-9(1)该厂生产的BaCO
3因含有少量BaSO
4而不纯,提纯的方法是:将产品加入足量的饱和Na
2CO
3溶液中,充分搅拌,过滤,洗涤.用离子方程式说明提纯原理:
(2)上述流程酸溶时,Ba(FeO
2)
2与HNO
3反应生成两种硝酸盐,化学方程式为:
(3)该厂结合本厂实际,选用的X为
;
A.BaCl
2 B.BaCO
3 C.Ba(NO
3)
2 D.Ba(OH)
2(4)废渣2为
(5)操作Ⅲ为
(6)过滤3后的母液应循环到容器
中.(填“a”、“b”或“c”)
(7)称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m克,则该Ba(NO
3)
2的纯度为
(相对分子质量:Ba(NO
3)
2为261,BaSO
4为233)




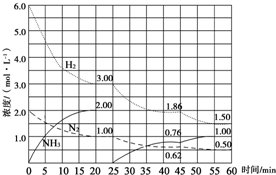 氨是最重要的氮肥,是产量最大的化工产品之一.
氨是最重要的氮肥,是产量最大的化工产品之一.