
| A. | 稀硝酸是弱酸,浓硝酸是强酸 | |
| B. | 稀硝酸与活泼金属反应主要放出氢气,而浓硝酸则通常使金属钝化 | |
| C. | 浓硝酸、稀硝酸和浓硫酸都是强氧化剂 | |
| D. | 室温下,铜既可与浓硝酸反应,又可与稀硫酸反应 |
 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、SO42-、Fe3+、Na+ | B. | Ca2+、NO3-、AlO2-、Cl- | ||
| C. | NO3-、I-、K+、Mg2+ | D. | K+、SO42-、Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验内容 | 实验目的 |
| A. | 用pH试纸测定相同浓度的CH3COONa溶液和NaHCO3溶液的pH | 比较CH3COOH和H2CO3的酸性强弱 |
| B. | 向AgCl浊液中滴加少量的0.1mol•L-1Na2S溶液 | 比较AgCl和Ag2S的溶度积大小 |
| C. | 向1 mol•L-1的稀硫酸中加入ag锌粉,向4 mol•L-1的稀硫酸的中加入ag锌粒 | 探究固体表面积对Zn与稀硫酸反应速率的影响 |
| D. | 将两个完全相同且充满NO2气体的密闭烧瓶分别浸在热水和冰水中 | 探究温度对化学平衡的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HS-+H2O?H3O++S2- | B. | CO2+2 H2O?HCO3-+H3O+ | ||
| C. | NH4++2H2O?NH3•H2O+H3O+ | D. | HCO3-+OH-?CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水与氯化铵的混合溶液显中性则:c(Cl-)>c(NH4+) | |
| B. | 0.2 mol/L的亚硫酸氢钠溶液中:c(OH -)+c(SO32-)=c(H+)+c(H2SO3) | |
| C. | 向0.2 mol/LNaHCO3溶液中加入等体积0.1 mol/LNaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,0.05 mol/LCH3COONa和0.05 mol/LCH3COOH等体积混合溶液:c( CH3COO-)+c(CH3COOH)=0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸的电离方程式:H2CO3?2H++CO32- | |
| B. | 碱性氢氧燃料电池负极的电极反应式:H2-2e-=2H+ | |
| C. | HCO3-的水解方程式:HCO3-+H2O?CO32-+H3O+ | |
| D. | 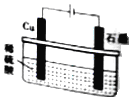 如图所示,反应开始时的离子方程式:Cu+2H+$\frac{\underline{\;通电\;}}{\;}$Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得红棕色液体为氢氧化铁胶体 | |
| B. | 向该液体中逐滴加盐酸,开始时产生沉淀,盐酸足量时,沉淀消失 | |
| C. | 该液体含分散质微粒0.1 mol | |
| D. | 该液体具有丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3与BaCl2溶液作用,有白色沉淀生成,加稀HNO3后沉淀消失 | |
| B. | 将SO2气体分别通入Ba(OH)2溶液、FeCl3与BaCl2的混合溶液、HNO3酸化的BaCl2溶液中,均可有白色沉淀生成 | |
| C. | 将SO2气体通入BaCl2溶液中没有白色沉淀生成,将SO2气体通入Ba(NO3)2溶液中有白色沉淀生成 | |
| D. | 将SO2气体、Cl2一起通入BaCl2溶液中,或将SO2气体、NO2气体一起通入BaCl2 溶液中,均有白色沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com