
【题目】“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
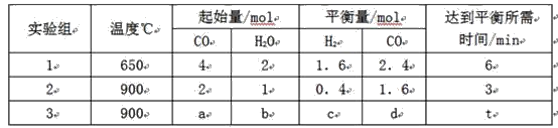
①实验2条件下平衡常数K=______________。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值_______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时v正_________v逆(填“<”,“>”,“=”)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1H2C2O4溶液中滴加10mL 0.01mol·L-1NaOH溶液时,比较溶液中各种离子浓度的大小关系_____________;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为_______________mol/L。
(5)以二甲醚(CH3OCH3)、空气、H2SO4为原料,铂为电极可构成燃料电池,其工作原理与甲烷燃料电池的原理相似。请写出该电池负极上的电极反应式:__________________。
【答案】![]() 或0.17 <1 (填0<a/b<1亦可) < CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ∕mol; c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) 5.6×10-5 CH3OCH3-12e-+3H2O=2CO2+12H+
或0.17 <1 (填0<a/b<1亦可) < CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ∕mol; c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) 5.6×10-5 CH3OCH3-12e-+3H2O=2CO2+12H+
【解析】
(1)①化学平衡常数K=![]() ;
;
②若平衡时,CO的转化率大于水蒸气,则![]() >
>![]() ;
;
③根据浓度商与化学平衡常数相对大小判断反应方向,从而确定正逆反应速率相对大小;
(2)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol,②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol,③H2O(g)=H2O(l)△H=-44.0kJ/mol,根据盖斯定律由![]() +2③可得CH3OH(l)+O2(g)=CO(g)+2H2O(l),再计算△H;
+2③可得CH3OH(l)+O2(g)=CO(g)+2H2O(l),再计算△H;
(3)草酸氢钠(NaHC2O4)溶液显酸性,说明草酸氢根离子电离程度大于水解程度,但水解和电离程度都较小;
(4)根据c(CaCl2)=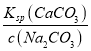 计算;
计算;
(5)该燃料电池中,负极上燃料失电子发生氧化反应。
(1)①平衡时c(CO)=![]() =0.8mol/L,c(H2)=
=0.8mol/L,c(H2)=![]() =0.2mol/L,c(H2O)=
=0.2mol/L,c(H2O)=![]() =0.6mol/L,c(CO2)=c(H2)=
=0.6mol/L,c(CO2)=c(H2)=![]() =0.2mol/L,化学平衡常数K=
=0.2mol/L,化学平衡常数K=![]() =
=![]() =
=![]() 或0.17;
或0.17;
②根据方程式知,参加反应的CO的物质的量等于生成氢气的物质的量,所以a-d=c,若平衡时,CO的转化率大于水蒸气,则![]() >
>![]() ,
,![]() <
<![]() =1,其转化率大于0,所以0<
=1,其转化率大于0,所以0<![]() <
<![]() =1;
=1;
③c(CO)=c(H2)=c(H2O)=c(CO2)=![]() =0.5mol/L,Qc=
=0.5mol/L,Qc=![]() =
=![]() =1>K,说明平衡向逆反应方向移动,则V正<V逆;
=1>K,说明平衡向逆反应方向移动,则V正<V逆;
(2)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol,②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol,③H2O(g)=H2O(l)△H=-44.0kJ/mol,根据盖斯定律由![]() +2③可得CH3OH(l)+O2(g)=CO(g)+2H2O(l),则△H=
+2③可得CH3OH(l)+O2(g)=CO(g)+2H2O(l),则△H=![]() +2×(-44.0kJ/mol)=-442.8 kJ∕mol;
+2×(-44.0kJ/mol)=-442.8 kJ∕mol;
(3)二者恰好反应生成草酸氢钠,草酸氢钠溶液呈酸性c(H+)>c(OH-),则草酸氢根离子电离和水电离都生成氢离子,草酸氢根离子水解和电离程度较小,所以离子浓度大小顺序是c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(4)等体积混合后混合溶液中c(Na2CO3)=1×10-4mol/L,根据溶度积常数得混合溶液中c(CaCl2)=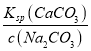 =
=![]() mol/L=2.8×10-5mol/L,二者等体积混合时溶质浓度降为原来的一半,所以原来氯化钙浓度为5.6×10-5mol/L;
mol/L=2.8×10-5mol/L,二者等体积混合时溶质浓度降为原来的一半,所以原来氯化钙浓度为5.6×10-5mol/L;
(5)该燃料电池中,负极上二甲醚失电子和水反应生成二氧化碳和氢离子,电极反应式为CH3OCH3-12e-+3H2O=2CO2+12H+。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】如图所示的A、B两个电解池中的电极均为铂,在A池中加入0.05 mol·L1的CuCl2溶液,B池中加入0.1 mol·L1的AgNO3溶液,进行电解。a、b、c、d四个电极上所析出的物质的物质的量之比是

A.2∶2∶4∶1B.1∶1∶2∶1
C.2∶1∶1∶1D.2∶1∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别将四块形状相同、质量为7g的铁块同时投入下列四种溶液中。铁块最快溶解完的是( )
A.250.0mL2mol·L-1HClB.150.0mL2mol·L-1H2SO4
C.40.0mL5mol·L-1HClD.20.0mL18.4mol·L-1H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL未知浓度的NaOH溶液和V2mL1.50mol·L-1HCl混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )
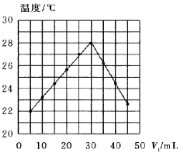
A.由图可知,做该实验时环境温度为22℃
B.该实验表明反应中化学能只能转化为热能
C.NaOH溶液的浓度约是1.00mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的化工原料,可由乙烷为原料制取。请回答下列问题:
(1)传统的热裂解法和现代的氧化裂解法的热化学方程式如下:
C2H6(g)=C2H4(g)+H2(g) ΔH1=+136kJ·mol-1
C2H6(g)+![]() O2(g)=C2H4(g)+H2O(g) ΔH2=-110kJ·mol-1
O2(g)=C2H4(g)+H2O(g) ΔH2=-110kJ·mol-1
已知水的汽化热为H2O(l)=H2O(g) ΔH3=+44kJ·mol-1
且反应相关的部分化学键键能数据如下:
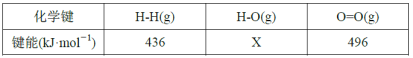
①由此计算x=___,通过比较ΔH1和ΔH2,说明氧化裂解法中通入氧气的作用是___。
②其他条件相同,对于氧化裂化法制乙烯的反应中,实验测得在T1和P1与T2和P2条件下该反应的C2H6平衡转化率相同,若T1>T2,则P1___P2(填“>”、“<”或“=”)。
③请求出下列反应的反应热:C2H6(g)+![]() O2(g)=C2H4(g)+H2O(l) ΔH3=___。
O2(g)=C2H4(g)+H2O(l) ΔH3=___。
(2)一定条件下,在体积为2L的密闭容器中,充入1molC2H6发生传统裂解法制乙烯。
①某温度下,10min后该反应达平衡,此时C2H6的物质的量浓度为0.2mol·L-1,从反应开始到平衡,乙烯的平均反应速率v(C2H4)=___。
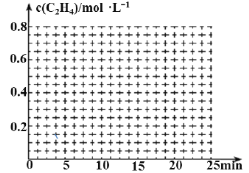
②在其它条件不变的情况下,15min时升高体系温度,20min达到新平衡,请在下边的坐标系中画出0~25 min,c(C2H4)随时间变化曲线:____。
(3)乙烷的氧化裂解反应产物中除了C2H4外,还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。乙烷的转化率随温度的升高而升高的原因是___;反应的最佳温度为___(填选项序号)。
A.700℃ B.750℃ C.850℃ D.900℃
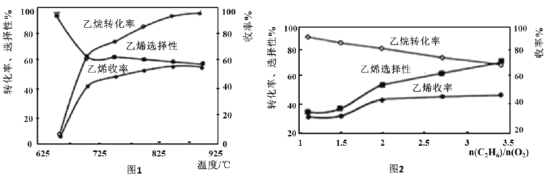
[乙烯选择性=![]() ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性]
(4)烃类氧化反应中,氧气含量低会导致反应产生积炭,堵塞反应管。图2为n(C2H6)/n(O2)的值对乙烷氧化裂解反应性能的影响。判断乙烷氧化裂解过程中![]() 的最佳值是___;判断的理由是___。
的最佳值是___;判断的理由是___。
(5)工业上,保持体系总压恒定为100kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是___。
(6)反应达平衡时,各组分的体积分数如下表:
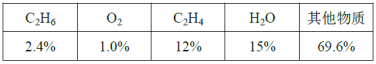
计算该温度下的平衡常数Kp=___(用平衡分压代替平衡浓度,平衡分压=总压×体积分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某复合肥的主要成分有KCl、NH4H2PO4和CO(NH2)2等。测定该复合肥中氮的质量分数的实验步骤如下:
步骤1:准确称取0.5000 g样品于锥形瓶中,加入足量浓硫酸并加热,不再有CO2溢出时,冷却至室温。
步骤2:向锥形瓶中加入100mL蒸馏水,再加入适量的CaCl2溶液,并用NaOH溶液调节溶液近中性,过滤,洗涤,得0.1550 gCa3(PO4)2沉淀和滤液A。
步骤3:向滤液A中加入过量的甲醛溶液,加指示剂,用0. 5000 mol/LNaOH标准溶液滴定至终点,消耗NaOH溶液22.00 mL。 [已知:4 NH4++6HCHO=4H++(CH2)6N4+6H2O]
(1)步骤1中,CO(NH2)2与硫酸反应的化学方程式为____________________。
(2)欲使滤液A中c(PO43—)≤4.0×10-6mol/L,应保持溶液中c(Ca2+)≥______________mol/L[已知KSP[Ca3(PO4)2]=2.0×10-33]。
(3)复合肥样品中N的质量分数为___________。
(4)计算复合肥样品中NH4H2PO4和CO(NH2)2的物质的量之比_____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
B.0.l0mol·L-1的氨水加水稀释后,溶液中c(NH4+)、c(OH-)变大
C.常温下,向水中加入少量Na2CO3固体后,c(H+)会减小,但Kw不变
D.若![]() LpH=11的NaOH溶液与
LpH=11的NaOH溶液与![]() LpH=3的HA溶液混合后显中性,则
LpH=3的HA溶液混合后显中性,则![]() ≤
≤![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法中可以说明2HI(g)![]() H2(g)+I2(g)已达到平衡的是:①单位时间内生成n mol H2的同时生成n mol HI;②一个H–H键断裂的同时有两个H–I键断裂;③百分组成ω(HI)=ω(I2);④反应速率υ(H2)=υ(I2)=1/2υ(HI)时;⑤ c(HI):c(H2):c(I2)=2:1:1时;⑥温度和体积一定时,容器内压强不再变化;⑦温度和体积一定时,某一生成物浓度不再变化;⑧条件一定,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体的颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化。( )
H2(g)+I2(g)已达到平衡的是:①单位时间内生成n mol H2的同时生成n mol HI;②一个H–H键断裂的同时有两个H–I键断裂;③百分组成ω(HI)=ω(I2);④反应速率υ(H2)=υ(I2)=1/2υ(HI)时;⑤ c(HI):c(H2):c(I2)=2:1:1时;⑥温度和体积一定时,容器内压强不再变化;⑦温度和体积一定时,某一生成物浓度不再变化;⑧条件一定,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体的颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化。( )
A. ②③⑤ B. ①④⑦ C. ②⑦⑨ D. ⑧⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 质子膜燃料电池工作原理如图。下列说法不正确的是
质子膜燃料电池工作原理如图。下列说法不正确的是![]()
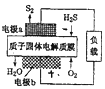
A.电池工作时,电流从电极b经过负载流向电极a
B.电极a上发生的电极反应式为![]()
C.电路中通过4mol电子时,4mol![]() 经质子膜进入正极区
经质子膜进入正极区
D.当反应生成64![]() 时,电池内部释放632kJ热量
时,电池内部释放632kJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com