
【题目】下列各组离子,在酸性溶液中可以大量共存的是( )
A.K+、Na+、HCO3-、Cl-B.Na+、Al3+、SO42-、NO3-
C.NH4+、K+、OH-、SO42-D.Ba2+、Na+、NO3-、CO32-
科目:高中化学 来源: 题型:
【题目】运用化学反应原理分析解答以下问题:
(1)弱酸在水溶液中存在电离平衡,部分0.1molL﹣1弱酸的电离平衡常数如下表:
弱酸 | 电离平衡常数(25℃) |
HClO | K=2.98×10﹣8 |
H2CO3 | K1=4.3×10﹣7 |
H2SO3 | K1=1.54×10﹣2 |
①当弱酸的浓度一定时,降低温度,K值(填“变大”“变小”或“不变”).
②下列离子方程式和有关说法错误的是 .
a.少量的CO2通入次氯酸钠溶液中:2ClO﹣+H2O+CO2═2HClO+CO32﹣
b.少量的SO2通入碳酸钠溶液中:SO2+H2O+2CO32﹣═2HCO3﹣+SO32﹣
c.相同温度时,等物质的量浓度的三种弱酸与足量NaOH溶液完全中和消耗NaOH的体积为V(H2CO3)>V(H2SO3)>V(HClO)
d.相同温度时,等pH三种盐溶液的物质的量浓度关系:c(Na2CO3)<c(NaClO)<c(Na2SO3)
③亚硒酸(H2SeO3)也是一种二元弱酸,有较强的氧化性.往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式: .
(2)工业废水中常含有一定量的Cr2O72﹣和CrO42﹣ , 它们对人类及生态系统会产生很大损害,必须进行处理后方可排放. ①在废水中存在平衡:2CrO42﹣(黄色)+2H+Cr2O72﹣(橙色)+H2O.若改变条件使上述平衡向逆反应方向移动,则下列说法正确的是 .
a.平衡常数K值可以不改变
b.达到新平衡CrO42﹣的消耗速率等于Cr2O72﹣的消耗速率
c.达到新平衡后,溶液pH一定增大
d.再达平衡前逆反应速率一定大于正反应速率
②Cr2O72﹣和CrO42﹣最终生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH﹣(aq),常温下Cr(OH)3的Ksp=10﹣32 , 当c(Cr3+)降至10﹣3 molL﹣1 , 溶液的pH调至4时,(填“有”或“没有”)沉淀产生.
(3)已知:①2CH3OH(g)CH3OCH3(g)+H2O(g) ②CO(g)+2H2(g)CH3OH(g)
③CO(g)+H2O(g) CO2(g)+H2(g)
某温度下三个反应的平衡常数的值依次为K1、K2、K3 , 则该温度下反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)的化学平衡常数K=(用含K1、K2、K3的代数式表示).向某固定体积的密闭容器中加入3mol CO和3mol H2 , 充分反应后恢复至原温度,测定容器的压强为反应前的 ![]() ,则CO的转化率为 .
,则CO的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一种有机物,通过元素分析得到的数据为C:85.71%,H:14.29%(质量分数).质谱数据表明它的相对分子质量为84.已知该物质可能存在多种结构,A、B和C是其中的三种.请根据下列要求填空:
(1)该化合物的分子式为;
(2)A与氢气加成生成2﹣甲基戊烷,则A的结构可能有种(考虑顺反异构);
(3)经检验B不能使酸性高锰酸钾溶液褪色,且一氯代物只有两种,则B的结构简式为
(4)已知烯烃能发生反应: ![]()
C经臭氧化并经锌和水处理生成D和E,如图: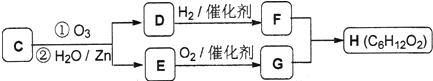
己知D常温为气体,H核磁共振氢谱显示有两组峰,峰面积之比为3:1.
①物质C的名称:;
②E与银氨溶液反应的化学方程式为:;
③F与G生成H的化学方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验细节正确的是( )
A. 用25mL量筒量取12.36mL稀硫酸
B. 水银洒落桌面,应该立即用抹布擦掉,再用大量水冲洗
C. 实验室制取蒸馏水时,温度计水银球在蒸馏烧瓶支管口处
D. 配置一定物质的量浓度溶液,容量瓶应洗净烘干,不能有水滴残留。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图填空。
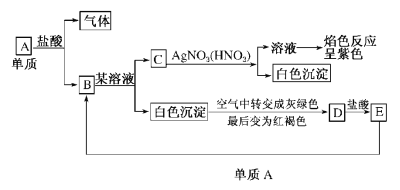
(1)写出下列各物质的化学式:
A__________,B__________,C__________,
D__________,E__________。
(2)写出生成D的反应方程式_____________________________。
(3)写出E→B的离子方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、G、H、I、J是中学化学常见的9种化合物,F、H常温下呈气态,B常温下呈液态,其中F是人类生存不能离开的气体单质,反应③常用于焊接和切割金属,其转化关系如下图,据此回答下列问题:
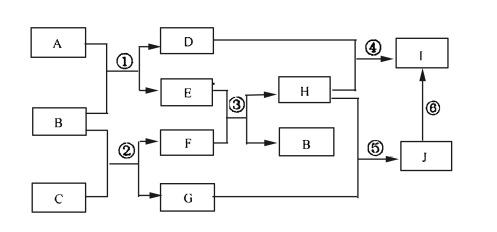
(1)写出C的电子式__________________。
(2)写出反应①的化学方程式______________________。
(3)列出两种E能发生的反应类型_________________________。
(4)写出过量的H与D溶液反应的离子方程式________________。
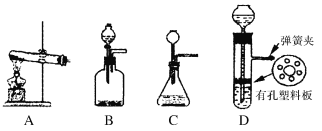
(5)实验室制取H的装置可以选用下列装置中的(填下图中的选项字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电石中的CaC2与H2O反应可用于制C2H2:CaC2+2H2O→C2H2↑+Ca(OH)2。通过排水测量出反应产生的气体的体积,从而可测定电石中碳化钙的含量。
(1)若使用下列仪器和导管组装实验装置,如下所示:
仪器和 导管 |
|
|
|
仪器和 导管 |
|
|
|
每个橡皮塞都打了两个孔 | |||
如果所制气体从左向右通过时,上述仪器和导管从左到右直接连接的顺序是(填仪器与导管的序号):
________接________接________接________接________接________。
(2)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次):
①称取一定量电石,置于仪器3中,塞紧橡皮塞。
②检查装置的气密性。
③在仪器6和5中注入适量水。
④待仪器3恢复到室温时,量取仪器4中水的体积(导管2中水忽略不计)。
⑤慢慢开启仪器6的活塞,使水逐滴滴下至不产生气体为止,关闭活塞。
正确的操作顺序是(用操作编号填空)________。
(3)若实验产生的气体有难闻的气味,且测定结果偏大,这是因为电石中含有________杂质。
(4)若实验时称取电石为1.60 g,测量出排水的体积后,折算成标准状况下乙炔的体积为448 mL,求此电石中碳化钙的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是( )
A. ③②①⑤④ B. ①②③⑤④ C. ②③⑤①④⑤ D. ③⑤②①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com