
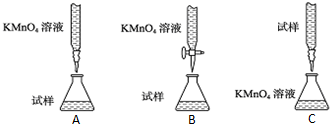
分析 (1)根据配制一定物质的量浓度的溶液的操作步骤判断:在配制物质的量浓度的溶液时,要经过:计算→称量→溶解→移液、洗涤→振荡→定容→摇匀等步骤;
(2)高锰酸钾具有强氧化性,能氧化碱式滴定管乳胶;滴定终点时,高锰酸钾稍过量,此时溶液出现浅红色半分钟不褪色;滴定发生的是氧化还原反应,稀释不影响滴定结果;
(3)锌粉能与Fe3+反应,加入锌粉的目的是将Fe3+恰好还原成Fe2+;
(4)根据物质的性质和书写离子方程式的有关要求书写离子方程式;
(5)根据离子方程式计算晶体中铁的质量分数;若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高.
解答 解:(1)在配制物质的量浓度的溶液时,要经过:计算→称量→溶解→移液、洗涤→振荡→定容→摇匀等步骤;
故答案为:溶解;定容;
(2)高锰酸钾具有强氧化性,能氧化碱式滴定管乳胶,故选用酸式滴定管盛放高锰酸钾溶液;滴定终点时,高锰酸钾稍过量,此时溶液出现浅红色半分钟不褪色;滴定发生的是氧化还原反应,稀释不影响滴定结果;
故答案为:B;碱式滴定管乳胶易被腐蚀;出现浅红色半分钟不褪色;无影响;
(3)加入锌粉的目的是将Fe3+恰好还原成Fe2+,使Fe2+在步骤三中与KMnO4发生氧化还原反应;
故答案为:将Fe3+恰好还原成Fe2+;
(4)在步骤三中高锰酸钾氧化Fe2+生成Fe3+,离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(5)根据步骤三中的离子反应可知:n(Fe)=5n(MnO4-)=5×$\frac{20.02ml+19.98ml}{2}$×0.01 mol•L-1×10-3×20=2.0×10-2mol,m(Fe)=56 g•mol-1×2.0×10-2mol=1.12g.晶体中铁的质量分数=$\frac{1.12g}{10g}$×100%=11.2%,若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高;
故答案为:11.20%;偏高.
点评 本题考查较为综合,涉及到溶液的配制、滴定和结晶等操作,注意基础实验知识的积累,把握实验步骤、原理和注意事项等问题,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
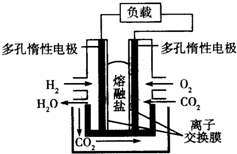
| A. | CO2在电池反应过程中不参与反应 | |
| B. | 电池总反应为2H2O═O2↑+2H2↑ | |
| C. | 该离子交换膜为阳离子交换膜 | |
| D. | 电池正极反应式为O2+2CO2+4e-═2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol KClO3参加反应,转移2mol电子 | |
| B. | KClO3在反应中被还原 | |
| C. | H2C2O4的还原性强于ClO2 | |
| D. | CO2是H2C2O4被氧化后得到的产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:Z>X>W | |
| B. | 单质的沸点:Z>X | |
| C. | 原子的最外层电子数:Y>W>Z | |
| D. | 标准状况下,5.6LW的单质中含有0.5mol原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙二醇 丙三醇 | B. | C6H5-OH C6H5CH2-OH | ||
| C. | C3H6 和C4H8 | D. | C2H6和C10H22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com