
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 恰好完全反应。B单质与D单质反应后可形成离子化合物
恰好完全反应。B单质与D单质反应后可形成离子化合物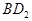 ;B单质与E单质可形成化合物BE。D的阴离子比B的阳离子多一个电子层,而E阴离子与B的阳离子电子层结构相同。
;B单质与E单质可形成化合物BE。D的阴离子比B的阳离子多一个电子层,而E阴离子与B的阳离子电子层结构相同。 的化学键类型是: .
的化学键类型是: .查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 相 关 信 息 |
| R | R在周期表中的周期数、族序数与其原子序数均相等 |
| X | X原子形成的化合物种类最多 |
| Y | Y的氢化物与其最高价氧化物的水化物化合生成一种盐 |
| Z | Z原子的最外层电子数为K层电子数的3倍 |
| Q | Q存在质量数为23,中子数为12的核素 |
| W | W在所处周期中原子半径最小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
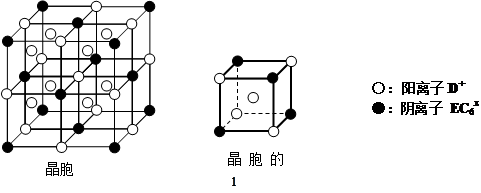
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素R位于周期表中第ⅤA族 |
| B.RO3—中的R只能被还原 |
| C.每反应消耗1 mol RO3—,转移电子的物质的量为5 mol |
| D.R2在常温常压下一定是气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com