
| 溶解性(本身均可做溶剂) | 沸点(℃) | 密度(g/mL) | |
| 乙醇 | 与水混溶,易溶于有机溶剂 | 78.5 | 0.8 |
| 溴乙烷 | 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
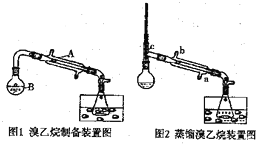
分析 (1)①根据仪器的作用与特征分析仪器A的名称为直形冷凝管;②根据烧瓶中溶液体积不超过约占$\frac{2}{3}$,结合反应的液体总体积分析;
(2)两个水槽中的液体均是冰水,使用冰水是为了冷凝产物CH3CH2Br,降温,减少溴乙烷的挥发;
(3)HBr并和乙醇发生取代反应生成溴乙烷和水;
(4)溴乙烷中混有溴,除杂时注意溴和溴乙烷的性质角度考虑,溴水与碳酸钠反应消耗;溴乙烷与溶液不互溶,可用分液的方法分离;
(5)溴乙烷中混有水时,可加入无水CaCl2除去;蒸馏时冷水应从冷凝管的下端进入,上端出,与蒸汽逆流可充分冷凝;
(6)先求出n(乙醇)=$\frac{46ml×0.8g/ml}{46g/mol}$=0.8mol,n(溴乙烷)=$\frac{50mL×1.4g/ml}{109g/mol}$≈0.6422mol,然后根据转化率的概念来解答.
解答 解:(1)①根据仪器特征,仪器A的作用是冷凝回流,名称是直形冷凝管,故答案为:直形冷凝管;
②总体积约为140mL,烧瓶中溶液体积不超过$\frac{2}{3}$,则容器B的容积是250mL,故答案为:C;
(2)溴乙烷沸点只有38.4℃,沸点低,易挥发,两个水槽中的液体均是冰水,使用冰水的目的是:降温,减少溴乙烷的挥发,
故答案为:降温,减少溴乙烷的挥发;
(3)HBr并和乙醇发生取代反应生成溴乙烷和水:HBr+CH3CH2OH$\stackrel{△}{→}$CH3CH2Br+H2O,
故答案为:HBr+CH3CH2OH$\stackrel{△}{→}$CH3CH2Br+H2O;
(4)由于浓硫酸具有强氧化性,将HBr氧化物Br2,产物溴乙烷中混有单质溴,蒸馏不能完全除去杂质,并且操作麻烦,四氯化碳与溴乙烷、溴单质都会溶,会引入新的杂质,无水CaCl2、无水MgSO4都不能与单质溴反应,不能除去单质溴,碳酸钠溶液能和溴单质反应,溴单质被除去,溴乙烷与溶液不互溶,两者分层,用分液的方法分离,
故答案为:b; 分液;
(5)经过(3)处理后的目标产物中还含有少量的水,可通过向产品中加入一定量无水CaCl2或无水MgSO4
,为了充分冷凝,蒸馏时冷水应从冷凝管的下端a口进入,上端出,
故答案为:Cd;a;
(6)46mL乙醇的物质的量为n(乙醇)=$\frac{46ml×0.8g/ml}{46g/mol}$=0.8mol,则理论上应生成溴乙烷0.8moL,实际上生成溴乙烷50mL,n(溴乙烷)=$\frac{50mL×1.4g/ml}{109g/mol}$≈0.6422mol,则溴乙烷的产率为$\frac{0.6422mol}{0.8mol}$×100%≈80.275%,
故答案为:80.275.
点评 本题考查溴乙烷的实验室制取,侧重考查学生实验分析的能力,掌握实验原理和物质的性质是解题的关键,综合性较强,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 +9O2$\stackrel{点燃}{→}$6CO2+6H2O.
+9O2$\stackrel{点燃}{→}$6CO2+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红棕色的NO2加压后颜色先变深再变浅 | |
| B. | H2、I2、HI混合气体加压后颜色变深 | |
| C. | 合成氨时高温、高压对合成氨有利 | |
| D. | 醋酸溶液稀释时,溶液pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度相同、体积相同的O2和N2 | B. | 质量相等、密度不等的N2和C2H4 | ||
| C. | 体积相同、密度不等的CO和C2H4 | D. | 压强相同、体积相同的O2和H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 沸点/℃ |
| 三苯甲醇 | 380 |
| 乙醚 | 34.6 |
| 溴苯 | 156.2 |
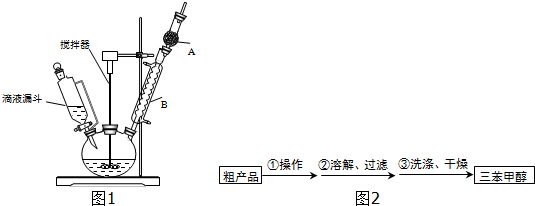
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 反应温度/℃ | 固液比 | c(Cl-)/mol•L-1 | 反应时间/h | |
| A | 95 | 1:5.5 | 0.8 | 6 |
| B | 100 | 1:5.5 | 0.7 | 7 |
| C | 110 | 1:6 | 0.9 | 8 |
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00mL | 0.02 | 40.01 |
| 2 | 25.00mL | 0.70 | 40.71 |
| 3 | 25.00mL | 0.20 | 39.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离出的C(H+)=10-13mol/L的溶液中K+、NO3-、Br-、Cl- | |
| B. | 含有大量NO3-的水溶液:I-、Fe3+、H+、Na+ | |
| C. | 弱碱性溶液中HCO3-、NH4+、C2H5O-、MnO4- | |
| D. | 无色透明溶液中:Ba2+、S2-、Cu2+、AlO2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com