
| A、pH=1的硫酸溶液所含的H+数为NA个 |
| B、20 g重水(D2O)中含有的电子数为10NA个 |
| C、粗铜电解精炼时,阳极减少6.4 g,则转移电子数一定是0.2 NA个 |
| D、在密闭容器中加入1molN2和3molH2充分反应可得到NH3分子数为2 NA个 |
| m |
| M |
| m |
| M |
| 20g |
| 20g/mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、研制高性能的耐磨轮胎,可减少细颗粒物(PM2.5)的产生 |
| B、将聚乙烯等塑料垃圾深埋或倾入海中 |
| C、利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气 |
| D、利用二氧化碳等原料合成聚碳酸酯类可降解塑料代替聚乙烯塑料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
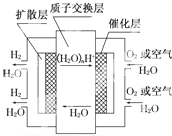
| A、正极反应为:O2+4H++4e-═2H2O |
| B、负极反应为:2H2-4e-═4H+ |
| C、导电离子为质子,且在电池内部由正极定向移动至负极 |
| D、总反应式为:2H2+O2═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+、H+、Cl-、SCN- |
| B、Fe2+、SO42-、H+、NO3- |
| C、Ca2+、HCO3-、Cl-、Na+ |
| D、K+、NH4+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.2L NO和11.2L O2混合后的分子总数为NA |
| B、1mol苯乙烯中含有的碳碳双键数为4NA |
| C、50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
| D、1mol Fe与足量的稀HNO3反应并放出NO和N2O,转移3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
| B、过量的SO2通入澄清石灰水中:Ca2++2OH-+SO2=CaSO3↓+H2O |
| C、盐酸与硅酸钠溶液混合:2H++SiO32-=H2SiO3↓ |
| D、硫酸铝溶液中加入到过量的烧碱中:Al3++3OH-=Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaSO4比BaCO3溶解度小,所以,BaCO3不可能转化为BaSO4 | ||
| B、BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂 | ||
C、任何温度下,向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,
| ||
| D、该温度下,BaCO3若要在Na2SO4溶液中转化为BaSO4,则Na2SO4浓度至少为2.2×10-6mol?L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮的单质和化合物在工农业生产中有着广泛的应用.
氮的单质和化合物在工农业生产中有着广泛的应用.
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com