
【题目】CH4是一种清洁、高效、具有优良的环保性能的燃料,其燃烧热为890.3KJ·mol-1。它可以作为燃料电池的燃料。
(1)写出甲烷燃烧的热化学方程式:________;
(2)已知H2(g)和C(S)的燃烧热分别是285.8kJ·mol-1、393.5kJ·mol-1;则反应C(S)+ 2H2(g)=CH4(g)的反应热⊿H=______________;
(3)以甲烷、空气、氢氧化钾溶液为原料,惰性电极为电极可以构成燃料电池。该电池的负极反应式为:___________________;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL滴有酚酞的NaCl溶液,装置如图所示:

①请写出电解过程中阴极附近观察到的现象:___________________。
②到燃料电池消耗2.8LO2(标准状况下)时,计算此时NaCl溶液的pH=____(假设溶液的体积不变,气体全部从溶液中逸出)。
在Y极通过的电子的物质的量为:______________。
③电解之后,要使溶液恢复原状,应该向溶液中加入物质_____(填名称),溶液中Cl―流向___极(填“X”或“Y”)。
【答案】CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol(其他合理答案亦可) -74.8kJ/mol CH4-8e-+10OH-=CO32-+7H2O 有无色气泡产生,同时阴极附近溶液由无色变红色 14 0.5mol 氯化氢气体 X
【解析】
(1)依据热化学方程式的书写方法,结合燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物时放出的热量写出,注意标注物质的聚集状态和燃烧热;
(2)根据燃烧热写出热化学方程式,再利用盖斯定律来计算;
(3)先判断氧化剂、还原剂,然后根据原电池原理判断正负极上反应的物质,结合电解质溶液写出电极反应式;
(4)依据电源判断X为电解池的阳极,Y为电解池的阴极;
①阴极是溶液中的氢离子得到电子生成氢气,溶液中水的电离被破坏,生成了氢氧根离子显碱性,遇酚酞变红;
②根据甲烷燃料电池的电极反应和电解氯化钠的电极反应,依据电子守恒计算得到;电极上的电子转移守恒;
③依据电解氯化钠溶液生成了氢气、氯气和氢氧化钠,恢复原溶液浓度需要加入氢气和氯气组成的氯化氢;电解过程中阴离子移向阳极。
(1)CH4是一种清洁、高效、具有优良的环保性能的燃料,其燃烧热为890.3kJmol-1,热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol(其他合理答案亦可)。
(2)25℃、101kPa下,H2(g)、C(s)的燃烧热分别是285.8kJmol-1、393.5kJmol-1;则①H2(g)+![]() O2(g)=H2O(l)△H=-285.8kJmol-1;②C(s)+O2(g)=CO2(g)△H=-393.5kJmol-1;③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol;依据盖斯定律,①×2+②-③得到:C(S)+2H2(g)=CH4(g)△H=-74.8kJ/mol;
O2(g)=H2O(l)△H=-285.8kJmol-1;②C(s)+O2(g)=CO2(g)△H=-393.5kJmol-1;③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol;依据盖斯定律,①×2+②-③得到:C(S)+2H2(g)=CH4(g)△H=-74.8kJ/mol;
故答案为:-74.8kJ/mol。
(3)负极上的电极反应式等于电池的总反应式-正极发生的电极方程式;以甲烷、空气、氢氧化钾溶液为原料,惰性电极可构成燃料电池,正极反应为:3O2+12H2O+12e-=12OH-,总反应式为:CH4+2O2+2OH-=CO32-+3H2O,两式相减,负极反应为:CH4-8e-+10OH-=CO32-+7H2O,
故答案为:CH4-8e-+10OH-=CO32-+7H2O。
(4)燃料电池为电源,以石墨为电极电解500mL滴有酚酞的NaCl溶液,X为电解池的阳极,Y为电解池的阴极;
①阴极是溶液中的氢离子得到电子生成氢气,溶液中水的电离被破坏,生成了氢氧根离子显碱性,遇酚酞变红;电解过程中阴极附近观察到的现象是:有无色气泡产生,同时阴极附近溶液由无色变红色;
故答案为:有无色气泡产生,同时阴极附近溶液由无色变红色。
②甲烷燃料电池的正极消耗氧气,燃料电池消耗2.8LO2物质的量=2.8L÷22.4L/mol=0.125mol;正极反应为:3O2+12H2O+12e-=12OH-,计算得到电子转移为0.5mol;电解氯化钠溶液阴极电极反应为:2H++2e-=H2↑,根据水电离出的氢氧根离子和氢离子守恒,溶液中减少的氢离子和增加的氢氧根离子相同,计算得到生成氢氧根离子物质的量为0.5mol,c(OH-)=0.5mol/0.5L=1mol/L;所以溶液pH=14;电极上的电子守恒得到在Y极通过的电子的物质的量为0.5mol;
故答案为:14;0.5mol。
③电解氯化钠溶液生成了氢气、氯气和氢氧化钠,恢复原溶液浓度需要加入氢气和氯气组成的氯化氢气体;电解过程中阴离子移向阳极;故答案为:氯化氢气体;X。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】把2.7 g铝投入100 mL 3 mol·L-1的NaOH溶液中充分反应后,再滴入1 mol·L-1的盐酸溶液400 mL,其结果错误的是
A. 溶液显酸性B. 得到澄清透明溶液
C. 得到浑浊溶液D. 溶液中铝元素有两种微粒存在形式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的制取和草酸的性质,进行如下实验。
实验Ⅰ:探究草酸的制备
实验室用硝酸氧化淀粉水解液法制备草酸:C6H12O6+12HNO3 → 3H2C2O4+9NO2↑+3NO↑+9H2O。装置如下图所示:

(1)上图实验装置中仪器乙的名称为:___________,B装置的作用____________。
(2)检验淀粉是否完全水解所需要的试剂为:__________。
实验Ⅱ:探究草酸的不稳定性
已知:草酸晶体(H2C2O4·2H2O)无色,易溶于水,熔点为101℃,受热易脱水、升华,170℃以上分解产生H2O、CO和CO2。草酸的酸性比碳酸强,其钙盐难溶于水。

(3)请选取以上的装置证明草酸晶体分解的产物(可重复使用,加热装置和连接装置已略去)。仪器装置连接顺序为:C→______→______→______→______→D→A→F______
(4)若实验结束后测得A管质量减轻4.8g,则至少需分解草酸晶体的质量为_____g(已知草酸晶体的M=126g/mol)。
实验Ⅲ:探究草酸与酸性高锰酸钾的反应
(5)取一定量草酸溶液装入试管,加入一定体积的酸性高锰酸钾溶液,振荡试管,发现溶液开始缓慢褪色,后来迅速变成无色。(反应热效应不明显,可忽略不计)
该实验中草酸表现______性,该反应的离子方程式_____________________________________________,该反应的反应速率先慢后快的主要原因可能是___________________。
(6)设计实验证明草酸是弱酸。实验方案:________________________________ (提供的药品及仪器:蒸馏水、0.1mol·L-1NaOH溶液、pH计、0.1mol·L-1草酸溶液,其它仪器自选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是

A. 原子半径:Y>Z>W
B. 单质的还原性:X>Y
C. 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D. 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)硫酸工业生产中,反应产生SO2气体的设备名称___。
(2)以下物质中:①H2SO4,②CaCl2,③NaHS,④He,⑤镁。
化学键只含共价键的是___;只含离子键的是___。
(3)用双桥表示3Cl2+6KOH=5KCl+KClO3+3H2O电子转移的方和数目:___。
(4)在一定条件下,利用置换反应X+Y=W+Z,可实现物质之间的转化
①若X为Mg,W为C,则Z为(填化学式)___。
②若X为SiO2,工业上利用焦炭还原二氧化硅的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水晒盐得到的粗盐中还含有CaCl2、MgCl2、Na2SO4以及泥沙等杂质,以下是实验室制备精盐的实验方案:

(1)除去泥沙和沉淀选用图中___装置,B装置的操作名称是___,在上述方案中图中装置中不会用到的是___。

(2)第⑦步操作的名称是___,所用到的实验装置是图中的___(填字母);
(3)为除去粗盐中的可溶性杂质,通常采用以下三种试剂,a:Na2CO3溶液;b:BaCl2溶液;c:NaOH溶液,加入BaCl2试剂的目的是___,三种试剂加入的合理顺序是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯:![]() ,下列有关说法正确的是
,下列有关说法正确的是
A. 乙苯和苯乙烯均能发生取代反应、加聚反应和氧化反应
B. 用溴水可以区分苯乙烯和乙苯
C. 1 mol苯乙烯最多可与4 mol氢气加成,加成产物的一氯代物共有5种
D. 乙苯和苯乙烯分子中共平面的碳原子数最多都为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年3月8日,联合国妇女署在推特上发布了一张中国女科学家屠呦呦的照片。致敬她从传统中医药中找到了治疗疟疾的药物----青蒿素。
已知:青蒿素是烃的含氧衍生物,为无色针状晶体。乙醚沸点为35℃。
(1)我国提取中草药有效成分的常用溶剂有:水;或亲水性溶剂(如乙醇,与水互溶);或亲脂性溶剂(如乙醚,与水不互溶)。诺贝尔奖获得者屠呦呦及其团队在提取青蒿素治疗疟疾过程中,记录如下:“青蒿素的水煎剂无效;乙醇提取物的效用为30%~40%;乙醚提取物的效用为95%”。下列推测不合理的是_____;
A | 青蒿素在水中的溶解度很大 | B | 青蒿素含有亲脂的官能团 |
C | 在低温下提取青蒿素,效果会更好 | D | 乙二醇提取青蒿素的能力强于乙醚 |
(2)用下列实验装置测定青蒿素实验式的方法如下:
将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。

①装置D的作用是______,装置E中吸收的物质是______,装置F中盛放的物质是______。
②实验装置可能会产生误差,造成测定含氧量偏低,改进方法是______。
③合理改进后的装置进行实验,称得:
装置 | 实验前/g | 实验后/g |
E | 22.6 | 42.4 |
F | 80.2 | 146.2 |
则测得青蒿素的实验式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国用BeO、KBF4等原料制备KBe2BO3F2晶体,在世界上首次实现在177.3 nm深紫外激光倍频输出,其晶胞如图所示。下列说法错误的是( )
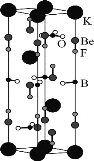
A. 构成晶体的非金属元素的电负性由大到小的顺序为F>O>B
B. KBF4中的阴离子的中心原子的杂化方式为sp2
C. 根据元素周期表中元素所处的位置可推测BeO与Al2O3性质相似
D. 晶胞中的K+有2个位于晶胞内部,8个位于晶胞顶点,则1mo1该晶胞含3molKBe2BO3F2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com