
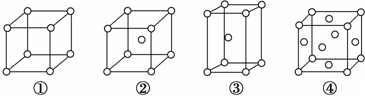
| A. | ②为六方最密堆积,③为体心立方堆积 | |
| B. | ③和④的配位数都是12 | |
| C. | 完全属于④的金属原子数为6个 | |
| D. | ③的空间利用率小于④ |
分析 A.②为体心立方堆积,③为六方最密堆积;
B.晶胞中原子的配位数分别为:①6,②8,③12,④12;
C.利用均摊法计算每个晶胞中原子个数;
D.空间利用率:①52%、②68%、③74%、④74%.
解答 解:A.①为简单立方堆积、②为体心立方堆积,③为六方最密堆积、④为面心立方最密堆积,故A错误;
B.晶胞中原子的配位数分别为:①6,②8,③12,④中配位数=3×8×$\frac{1}{2}$=12,故B正确;
C.中原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故C错误;
D.空间利用率:①52%、②68%、③74%、④74%,所以原子利用率顺序:①<②<③=④,故D错误;
故选B.
点评 本题考查金属堆积,侧重考查学生空间想象能力、计算能力,知道每种堆积模型中典型金属,难点是计算配位数,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
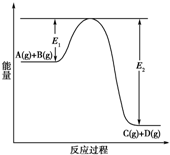 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如下图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如下图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入BaCl2溶液,有白色沉淀,则原溶液一定存在Ag+或SO42- | |
| B. | 根据纤维在火焰上燃烧产生的气味,可确定该纤维是否为蛋白质纤维 | |
| C. | 两份常温下均为饱和溶液(一份是NaOH溶液,一份是氢氧化钙溶液),上述两份饱和溶液可通过加入少量的NaOH固体而鉴别出 | |
| D. | 某矿石中加入足量的盐酸,根据放出的二氧化碳气体,可证明该矿石一定含有碳酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com