
 A、B、C、D4种短周期元素的原子序数依次增大,其中A、C及B、D分别是同主族元素,又知两元素的质子数之和B、D是A、C的2倍,这4种元素的单质中有2种是气体,2种是固体.
A、B、C、D4种短周期元素的原子序数依次增大,其中A、C及B、D分别是同主族元素,又知两元素的质子数之和B、D是A、C的2倍,这4种元素的单质中有2种是气体,2种是固体.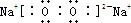 ;钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键,所以其晶体中存在的化学键有离子键和共价键,
;钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键,所以其晶体中存在的化学键有离子键和共价键,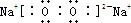 ;离子键和共价键;
;离子键和共价键;| 3600 | ||
|
| 185 |
| 286 |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
| 实验序号 | KClO3质量 | 其他物质的质量 | 待测数据 |
| ④ | 1.2g | 无其他物质 | |
| ⑤ | 1.2g | CuO 0.5g | |
| ⑥ | 1.2g | MnO2 0.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
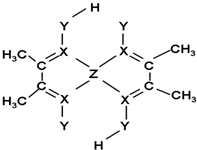
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3种 | B、4种 | C、5种 | D、6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
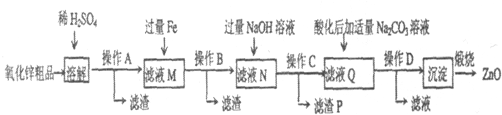
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com