
【题目】某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu 64)。
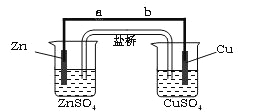
按照实验步骤依次回答下列问题:
(1)导线中电子流向为 (用a、b 表示)。
(2) 写出装置中锌电极上的电极反应式: ;
(3)若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为 ;(不许用“NA”表示 )
(4)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+,Cl-的移动方向描述正确的是 。
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向右侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(5)若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
A. NaOH B.Zn C.Fe D.H2SO4
(6)反应一段时间后右侧烧杯中Cu2+浓度是 (填增大 减小或不变)
【答案】(1)由a到b(或a→b);(2) Zn―2e―=Zn2+
(3)1.204×1022 (4)B (有错不得分) (5) B (有错不得分) (6) 减小
【解析】
试题分析:图为原电池装置,Zn为负极,Cu为正极;
(1)电子由负极流向正极,则电子流向为由a到b(或a→b);
(2)负极Zn失去电子,电极反应式为Zn-2e-=Zn2+;
(3)铜电极发生Cu2++2e-=Cu,增加0.64g,n(Cu)=![]() =0.01mol,转移0.02mol电子,转移电子数目为0.02mol×NA=1.204×1022;
=0.01mol,转移0.02mol电子,转移电子数目为0.02mol×NA=1.204×1022;
(4)盐桥中的K+、Cl-的移动方向为阳离子向正极移动,阴离子向负极移动,右侧为负极,左侧为正极,只有B正确,故答案为B;
(5)除去Cu2+,可促进其水解生成沉淀,注意不引入新的杂质,AC会引入杂质,D抑制水解,只有B符合,故答案为B;
(6)反应一段时间后因Cu2+被还原,右侧烧杯中Cu2+浓度减小。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加人3 mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g。则下列叙述中不正确的是 ( )
A.当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100 mI。
B.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol
C.参加反应的金属的总质量为9.6 g>m>3.6 g
D.当金属全部溶解时收集到NO气体的体积一定为2. 24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。
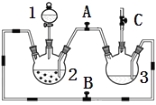
(1)稀硫酸应放在 中(填写仪器名称).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关 、打开开关 就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是 。
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O] (相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次来 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52[ | 25.02 | 24.98 |
滴定过程中发生反应的离子方程式为
滴定终点的现象是
通过实验数据计算的该产品纯度为 (用字母ac表示).上表中第一次实验中记录数据明显大于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用自来水养金鱼,在将水注入鱼缸之前,常须把水在阳光下曝晒一段时间,其目的是( )
A.增加水中的含氧量
B.起到杀菌作用
C.使水中的次氯酸分解
D.使水的硬度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是① ,X和Y中电负性较大的是 ② (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
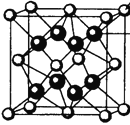
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如右图所示,则图中黑球代表的离子是_________(填离子符号)。
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关天然产物水解的叙述不正确的是
A.油脂水解可得到丙三醇
B.麦芽糖水解只生成葡萄糖
C.蛋白质水解的最终产物均为氨基酸
D.纤维素水解与淀粉水解得到的最终产物不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得,某有机物A相对分子质量为72。
(1)若A是烃,其分子式为______,它有_____种同分异构体,沸点最高的是__________________ (写结构简式)。若该烃与Cl2发生取代反应,生成的一氯代物只有1种,则该A的结构简式为______。
(2)若该有机物3.6g完全燃烧生成0.15molCO2和0.1molH2O,则A的分子式为_______。若它是一种不饱和羧酸,该酸与甲醇发生酯化反应的化学方程式为(注明反应条件):__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是
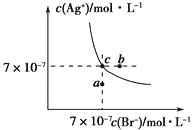
A. 在t℃时,AgBr的Ksp为4.9×10-13
B. 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C. 图中a点对应的是AgBr的不饱和溶液
D. 在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈816
AgBr(s)+Cl-(aq)平衡常数K≈816
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com