
【题目】NA是阿伏加德罗常数的值,下列说法正确的是( )
A.7.8g苯含σ键的数目为0.6NA
B.将Cl2通入FeBr2溶液中,有1molBr2生成时,转移的电子数为2NA
C.1molNH4NO3完全溶于稀氨水中,溶液呈中性,溶液中NH![]() 的数目为NA
的数目为NA
D.有铁粉参加的反应若生成3molFe2+,则转移电子数一定为6NA
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、Q、R 的原子序数依次增大,X 的简单阴离子与锂离子具有相同的电子层结构,Y原子最外层电子数等于内层电子数的2倍,Q 的单质与稀硫酸剧烈反应生成 X 的单质。向100mLX2R的水溶液中缓缓通入RZ2 气体,溶液pH与RZ2 体积关系如下图。下列说法正确的是( )
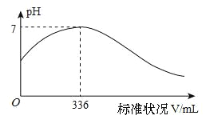
A. X2R 溶液的浓度为0.03mol·L-1
B. 最简单气态氢化物的稳定性:Y>Z>R
C. 工业上通常采用电解法冶炼Q的单质
D. RZ2 通入 BaCl2、Ba(NO3)2 溶液中,均无明显现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成。如图1装置是用燃烧法确定有机物分子式常用的装置。
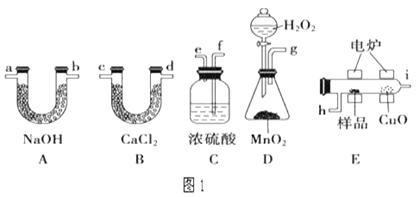
(1)燃烧管中CuO的作用是_____。
(2)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取1.48g样品,经充分反应后,A管质量增加3.52g,B管质量增加1.8g,则该样品的实验式为_____。
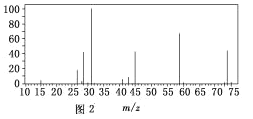
(3)用质谱仪测定其相对分子质量,得如图2所示的质谱图,则该有机物的相对分子质量为_____。
(4)若只根据A的实验式能否确定其分子式____(填“能”或“不能”)。
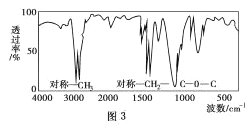
(5)该物质的红外光谱图如图3所示,则其结构简式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.环戊二烯(![]() )分子中所有原子共平面
)分子中所有原子共平面
B.同主族元素含氧酸的酸性随核电荷数的增加而减弱
C.二甲醚易溶于水,氨基乙酸的熔点较高,主要原因都与氢键有关
D.1-二环丙基乙烯(![]() )的二氯代物共有(不含立体异构)9种
)的二氯代物共有(不含立体异构)9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白桦脂酸对白血病等恶性肿瘤细胞有抑制作用,其结构简式如图所示,在白桦脂酸中加入合适的试剂检验其官能团(必要时可加热),下列试剂、现象、结论都正确的一项是

选项 | 试剂 | 现象 | 结论 |
A | 氯化铁溶液 | 溶液变色 | 含有羟基 |
B | 银氨溶液 | 有银镜产生 | 含有醛基 |
C | 碳酸氢钠溶液 | 有气泡产生 | 含有羧基 |
D | 酸性KMnO4溶液 | 溶液褪色 | 含有碳碳双键 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4∶5,化合物D是重要的工业原料。
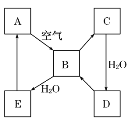
(1)写出A在加热条件下与H2反应的化学方程式:____。
(2)写出E与A的氢化物反应生成A的化学方程式:____。
(3)写出一个由D生成B的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南京理工大学团队成功合成了能在温室稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,经 X 射线衍射测得晶体结构,其局部结构如图所示(其中N5-的立体结构是平面五元环)。下列说法正确的是( )

A.所有N 原子的价电子层结构均有孤对电子
B.氮氮键的键能:N5->H2N-NH2
C.两种阳离子是等电子体
D.阴阳离子之间只存在离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置(如图)。

已知:
①溶液呈酸性且阴离子为SO42-;
②溶液中颜色:V3+绿色,V2+紫色,VO2+黄色,VO2+蓝色;
③放电过程中,右槽溶液的颜色由紫色变成绿色。
下列说法不正确的是
A.放电时B极为负极
B.放电时若转移的电子数为3.01×1023个,则左槽中H+增加0.5 mol
C.充电过程中左槽的电极反应式为:VO2++H2O-e- =VO2++2H+
D.充电过程中H+通过质子交换膜向右槽移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料制备硼酸(H3BO3)。

请回答下列问题:
(1)流程中“反应”的实验装置如图所示:

①反应时需控制在95℃进行,控制反应温度的适宜方法是____。
②反应产生的气体需要净化处理,请从图中选择合适的装置____(填字母代号)。

(2)根据如图所示,流程中“过滤”操作的适宜温度是________(填字母代号)。
A.0-20℃ B.20-40℃ C.50-60℃ D. 60-80℃

(3)根据H3BO3的电离反应:H3BO3+H2O![]() H++B(OH)4-,Ka=5.7×10-10,可判断H3BO3是____酸;将溶液pH调解至3.5目的是____。
H++B(OH)4-,Ka=5.7×10-10,可判断H3BO3是____酸;将溶液pH调解至3.5目的是____。
(4)实验时若被强碱溅到皮肤,先用大量水冲洗,水洗后再涂上硼酸溶液,写出有关离子方程式:____。
(5)实验中得到的粗硼酸还需要重结晶进行提纯,重结晶得到的母液可以在下一次重结晶时重复使用,但达到一定次数后必须净化处理,原因是____。
(6)预测定硼酸的纯度,因硼酸酸性过弱不能直接滴定。可先将硼酸与甘油作用生成甘油硼酸(Ka=8.4×10-6),再用NaOH标准溶液滴定(酚酞作指示剂)。已知硼酸的摩尔质量为61.8g·mol-1,滴定前称取3.00g硼酸试样,配成250mL溶液,每次取25.00mL于锥形瓶中滴定,消耗0.2000mol·L-1NaOH标准液的平均体积为20.00mL。
①计算所得硼酸的纯度____
②若用NaOH标准溶液直接滴定硼酸,测得的硼酸的纯度将____(填字母代号)。
A.偏大 B.偏小 C.无影响 D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com