
【题目】某合金与铁的物理性质的比较如表所示( )
项目 | 熔点/°C | 密度/ | 硬度(金刚 | 导电性 |
某合金 | 2 500 | 3.00 | 7.4 | 2.3 |
铁 | 1 535 | 7.86 | 4.5 | 17 |
从性能看,该合金不适合制( )
A.导线
B.门窗框
C.炉具
D.飞机外壳
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸。
反应原理:

反应试剂、产物的物理常数:
名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
水 | 乙醇 | 乙醚 | ||||||
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
主要实验装置和流程如下:

实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时, 反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。

(1)无色液体A的结构简式为 。操作Ⅱ为 。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是 。
(3)下列关于仪器的组装或者使用正确的是 。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入 ,分液,水层再加入 ,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近来, 科学家研制了一种新型的乙醇电池(DEFC), 它用磺酸类质子作溶剂, 在200℃左右时供电, 乙醇电池比甲醇电池效率高出32倍且更加安全。电池总反应式为: C2H5OH+3O2 ![]() 2CO2+3H2O。下列说法不正确的是
2CO2+3H2O。下列说法不正确的是
A.C2H5OH在电池的负极上参加反应 B.1 mol乙醇被氧化转移6 mol电子
C.在外电路中电子由负极沿导线流向正极 D.电池正极得电子的物质是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2与SO3(g)的反应类似于Na2O2与CO2(g)的反应,请写出Na2O2与SO3反应的化学方程式: . 每2molNa2O2参加反应,转移电子数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中化学资源的综合开发利用,已受到各国的高度重视。Br2和Mg等两种单质都可以从海水中提取,如图为提取它们的主要步骤:

请回答:
Ⅰ.从海水中提取的溴占世界溴年产量的三分之一,主要方法就是上述流程中的空气吹出法。
(1)制取Br2时第一次通入Cl2时发生反应的离子方程式是________________。
(2)吸收塔中反应的离子方程式是___________。
Ⅱ.镁及其合金是用途很广的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用______(写化学式)。
(2)加入试剂②后反应的离子方程式是_______________。
(3)步骤①包括加热、蒸发、冷却、结晶、____________。
(4)通电时无水MgCl2在熔融状态下反应的化学方程式是_______________。
Ⅲ.上述流程在生产溴和镁的同时还可以制得其他化工物质,比如制备耐火材料氧化镁和盐酸。生产方法是:
①将氯化镁晶体(MgCl26H2O)加热到523℃以上,该晶体可以分解得到耐火材料氧化镁和两种气态化合物,其中一种气体常温下为无色液体。
②将两种气体冷却至室温,再根据需要,加入不同量的水,就可得到不同浓度的盐酸.
(1)MgCl26H2O在523℃以上分解的化学方程式是___________。
(2)现用1molMgCl26H2O分解所得的非固体产物来制取密度为1.19g/cm3的盐酸溶液168mL,需加水_______g(精确到0.1),该盐酸中溶质的物质的量浓度是_________mol/L(精确到0.1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A.
光解水的催化材料可用硝酸镍、硫脲和锐钛矿为原料,采用醇热法制得。
(1)Ni2+基态核外电子排布式为__________________。
(2)与NO3-互为等电子体的一种分子的化学式为__________________。
(3)硫脲(![]() )中C原子轨道的杂化类型为__________________;
)中C原子轨道的杂化类型为__________________;
1 mol硫脲中含有键的数目为____________mol。
钛的一种氟化物晶胞结构如右图所示,其化学式为____________。
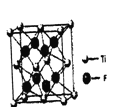
(5)甘油(丙三醇)具有保持水分的功效,其主要原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某不锈钢(主要成分为Fe)样品中含有铝、铜、硅等(其它成分忽略),为了测定该合金中铁的含量,有人设计如下工艺流程:

(1)滤渣A中主要含有__________、__________;操作①使用的玻璃仪器有__________
(2)写出向滤液A中通入Cl2所发生生反应的离子方程式:__________,写出加入过量NaOH溶液所发生反应的离子方程式__________.
(3)实验室进行步骤④用到的仪器有坩埚钳、酒精灯、三脚架、__________和__________
(4)对所得Fe2O3固体称量得质量为b g,计算该样品中铁元素的质量百分数的表达式为__________(用含a、b的式子表示)
(5)有同学用以上试剂设计了另一方案,也达到了同样的目的,依次加入的试剂是:加入足量 NaOH溶液;__________;__________; 加入足量 NaOH溶液;加热灼烧得Fe2O3固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列各组物质按单质、氧化物、酸、碱、盐分类顺序排列,其中正确的是
A. 镁、干冰、硫酸、纯碱、食盐 B. 碘酒、冰、盐酸、烧碱、硫酸钡
C. 氢气、生石灰、硝酸、一水合氨、氯化铜 D. 铁、氧化铜、醋酸、碱石灰、小苏打
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com