

分析 (1)根据药品说明书可以知道主要成分是碘单质;
(2)在甲试管中加入下列一种试剂,振荡、静置,观察到液体分层,目的从碘水中萃取碘单质,加入的试剂要求是:碘在萃取剂中的溶解度大于在水中的溶解度,萃取剂和水不互溶,且萃取剂和碘不反应,若上层液体颜色为无色,萃取剂密度大于水,碘单质遇淀粉变蓝,可以用于碘单质的检验.
解答 解:(1)该药品说明书指出:主要成分是分子碘,碘单质,分子式为:I2,
故答案为:I2;
(2)氢氧化钠和碘反应生成次碘酸钠和碘化钠,不分层,碘易溶于有机溶剂,且酒精与水不分层,碘和盐酸不反应,不分层,碘在CCl4中的溶解度大于在水中的溶解度,且碘与CCl4不反应,水与CCl4不互溶,碘在CCl4中在水的下层;萃取后,四氯化碳密度大,则观察到液体分层,下层呈紫红色,上层几乎无色,根据碘单质遇淀粉变蓝的特性来检验碘单质,
故答案为:C,淀粉.
点评 本题是以I2的基本性质为载体的实验探究题,综合考查碘单质的性质,包括颜色、萃取剂选择的理由,都属一些识记性知识,题目难度不大.


科目:高中化学 来源: 题型:解答题
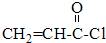 $→_{反应③}^{CH_{3}CH_{2}OH}$CH2=CH-COOCH2CH3
$→_{反应③}^{CH_{3}CH_{2}OH}$CH2=CH-COOCH2CH3 .(注明反应条件)
.(注明反应条件) 或CH2=CH-O-CH2-O-CH=CH2.
或CH2=CH-O-CH2-O-CH=CH2.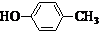 也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为
也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为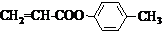 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 6:3:2 | C. | 3:2:1 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;取代反应;
;取代反应; ;取代反应;
;取代反应; ;加聚反应;
;加聚反应; CH3CH2OOCCOOCH2CH3+2H2O;酯化反应;
CH3CH2OOCCOOCH2CH3+2H2O;酯化反应;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4+2NaOH═Cu(OH)2↓+Na2SO4 | B. | Cl2+H2O?HCl+HClO | ||
| C. | Zn+H2SO4═ZnSO4+H2↑ | D. | 2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
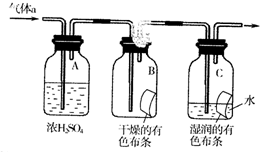 氯气是一种化学性质活泼的非金属单质,工业上
氯气是一种化学性质活泼的非金属单质,工业上查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com