
| A. | 强碱性溶液中:K+、Al3+、Cl-、SO42- | |
| B. | 能与铝反应放出氢气的溶液中:K+、Ca2+、Cl-、HCO3- | |
| C. | pH=2的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN- |
分析 A.强碱溶液中含大量的氢氧根离子;
B.能与铝反应放出氢气的溶液,为非氧化酸或强碱溶液;
C.pH=2的溶液,显酸性;
D.离子之间结合生成络离子.
解答 解:A.强碱溶液中含大量的氢氧根离子,不能大量存在Al3+,故A不选;
B.能与铝反应放出氢气的溶液,为非氧化酸或强碱溶液,酸碱溶液中不能大量存在HCO3-,故B不选;
C.pH=2的溶液,显酸性,该组离子之间不反应,可大量共存,故C选;
D.Fe3+、SCN-结合生成络离子,不能共存,故D不选;
故选C.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | “地沟油”经过加工处理后,可以用来制肥皂 | |
| B. | 二氧化硫有漂白性,大量用作棉,麻、纸张和食品的漂白 | |
| C. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 | |
| D. | PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
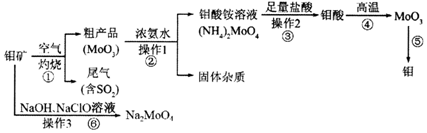
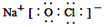 ;反应⑥生成三种钠盐,写出该反应的离子方程式:MoS2+OH-+ClO-=MoO42-+2SO42-+9Cl-+H2O
;反应⑥生成三种钠盐,写出该反应的离子方程式:MoS2+OH-+ClO-=MoO42-+2SO42-+9Cl-+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2 | B. | Fe2O3、SiO2 | C. | SiO2、Al2O3 | D. | Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 类别选项 | 碱 | 盐 | 电解质 | 非电解质 |
| A | 烧碱 | 小苏打 | BaSO4 | 干冰 |
| B | 纯碱 | CaCO3 | NH3•H2O | Fe |
| C | 明矾 | 食盐 | 石墨 | 醋酸 |
| D | KOH | CuSO4 | Na2SO4 | KClO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
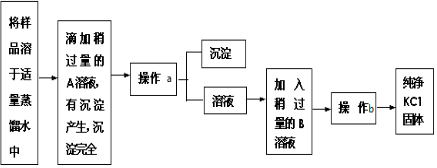
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
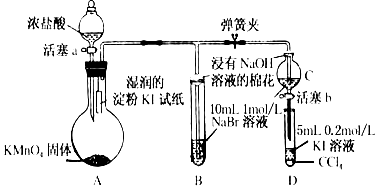
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
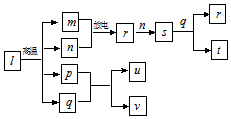 短周期主族元素X、Y、Z、W的原子序数依次增大.在如图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,p是W的单质,其余为由上述的两种或三种元素组成的化合物.u的水溶液具有漂白性;常温时,0.01mol•L-1t与0,.01mol•L-1 v溶液的pH均为2.下列说法不正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.在如图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,p是W的单质,其余为由上述的两种或三种元素组成的化合物.u的水溶液具有漂白性;常温时,0.01mol•L-1t与0,.01mol•L-1 v溶液的pH均为2.下列说法不正确的是( )| A. | 原子半径:r(X)<r(Z)<r(Y) | |
| B. | 简单氢化物的稳定性:Z>W>Y | |
| C. | 上述转化关系中的物质的类别有单质、酸及酸性氧化物等 | |
| D. | X、Y、Z三种元素形成的化合物中可能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
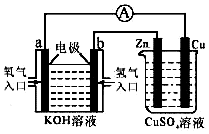 由化学能转变的热能或电能仍然是人类使用的主要能源,根据如图所示的装置,(其中a、b均为石墨电极)
由化学能转变的热能或电能仍然是人类使用的主要能源,根据如图所示的装置,(其中a、b均为石墨电极)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com