
【题目】氮的单质及其化合物性质多样,用途广泛。完成下列填空:
(1)用催化技术将汽车尾气中的NO和CO转变成CO2和N2,反应原理为:2NO(g)+2CO(g)![]() 2CO2(g)+N2 (g) +Q
2CO2(g)+N2 (g) +Q
某温度下测得该反应在不同时间的CO浓度如下表:
时间(s) 浓度 ×10-3(molL-1) | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
该反应平衡常数K的表达式____________________;温度升高,K值___________(选填“增大”、“减小”、“不变”);前2s内的平均反应速率v(N2)=_______________;若上述反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是_________。
(2)工业合成氨的反应温度选择500℃左右的主要原因是______________________。
(3)在固定容积的密闭容器中,加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是__________________________________________________。
(4)常温下向含1mol溶质的稀盐酸中缓缓通入1molNH3(溶液体积变化忽略不计),反应结束后溶液呈现酸性的原因________________________________(用离子方程式表示);在通入NH3的过程中溶液的导电能力______(选填“变大”、“变小”、“几乎不变”)。
【答案】 ![]() 减小 1.875×10-4mol/(L·s) 增大压强(或其它合理答案) 催化剂在500℃左右具有最佳活性 容器内的压强保持不变 或N2、H2、NH3的浓度不再发生变化(合理给分) NH4++H2O
减小 1.875×10-4mol/(L·s) 增大压强(或其它合理答案) 催化剂在500℃左右具有最佳活性 容器内的压强保持不变 或N2、H2、NH3的浓度不再发生变化(合理给分) NH4++H2O![]() NH3.H2O+H+ 几乎不变
NH3.H2O+H+ 几乎不变
【解析】(1)平衡常数等于生成物浓度的系数次幂之积除以反应浓度系数次幂之积,根据反应2NO(g)+2CO(g)![]() 2CO2(g)+N2 (g) ,平衡常数
2CO2(g)+N2 (g) ,平衡常数![]() ;该反应为放热反应,温度时平衡逆向移动,所以平衡常数减小;根据速率之比等于各物质系数比可知:v(CO)=(3.60×10-3-2.85×10-3)/2=3.75×10-4 mol/(L·s),前2s内的平均反应速率v(N2)=v(CO)/2=1.875×10-4 mol/(L·s);一氧化氮的转化率变大,说明平衡正向移动可以通过增大压强,使平衡正向移动;正确答案:
;该反应为放热反应,温度时平衡逆向移动,所以平衡常数减小;根据速率之比等于各物质系数比可知:v(CO)=(3.60×10-3-2.85×10-3)/2=3.75×10-4 mol/(L·s),前2s内的平均反应速率v(N2)=v(CO)/2=1.875×10-4 mol/(L·s);一氧化氮的转化率变大,说明平衡正向移动可以通过增大压强,使平衡正向移动;正确答案: ![]() ;减小 1.875×10-4mol/(L·s);增大压强(或其它合理答案)。
;减小 1.875×10-4mol/(L·s);增大压强(或其它合理答案)。
(2)工业合成氨的反应温度选择500℃左右的主要原因是催化剂在500℃左右具有最佳活性;正确答案:催化剂在500℃左右具有最佳活性。
(3)可逆反应达到平衡标志:各物质的浓度保持不变或容器内气体的压强保持不变或容器内气体的平均分子量保持不变等;正确答案:容器内的压强保持不变 或N2、H2、NH3的浓度不再发生变化(合理给分)。
(4)二者恰好反应生成氯化铵,水解方程式为NH4++H2O![]() NH3.H2O+H+;溶液呈酸性,即
NH3.H2O+H+;溶液呈酸性,即![]() ;根据溶液呈电中性有:
;根据溶液呈电中性有:![]() ,因为
,因为![]() ,
,![]() ,故离子浓度大小关系为:
,故离子浓度大小关系为:![]() ,溶液中离子浓度几乎不变,所以导电能力几乎不变,正确答案: NH4++H2O
,溶液中离子浓度几乎不变,所以导电能力几乎不变,正确答案: NH4++H2O![]() NH3.H2O+H+;几乎不变。
NH3.H2O+H+;几乎不变。


科目:高中化学 来源: 题型:
【题目】向平底烧瓶中放入氢氧化钡晶体[Ba(OH)2·8H2O]和氯化铵晶体,塞紧瓶塞。在瓶底和木板间滴少量水,如下图所示,一会儿,就会发现瓶内固态物质变稀,有液体生成,瓶壁变冷,小木板因少量水结冰冻结,而将烧瓶黏住,这时打开瓶塞,散发出来的气体有氨味。这是自发地发生了反应:Ba(OH)2·8H2O(s)+2NH4Cl(s)===BaCl2(s)+2NH3(g)+10H2O(l)。实验中的下列结论正确的是( )

A. 自发反应一定是放热反应
B. 自发反应一定是吸热反应
C. 有的吸热反应也能自发进行
D. 吸热反应不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家刚刚发现了某种元素的原子,其质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法不正确的是
A. 该原子的摩尔质量是a NA B. W g该原子的物质的量是:W/(aNA)mol
C. W g该原子中含有W/a个该原子 D. 由已知信息可得: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质互为同系物的是
A. O2和O3 B. CH3CH2CH2CH3和CH(CH3)3
C. 12C和13C D. CH3和CH3CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】爱国实业家侯德榜在氨碱法的基础上,发明了“联合制碱法”,简单流程如图。完成下列问题:
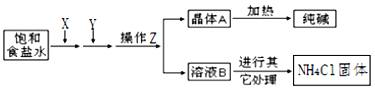
(1)在饱和食盐水中通入X和Y,则X______和Y_______(填物质名称),先通X后通Y的原因是_______________________。
(2)写出通入X和Y的化学反应方程式____________________________。
(3)操作Z包括________和________(填名称)。
(4)溶液B中含有的主要离子是_____________,为了得到化肥(NH4Cl),需要在溶液B中通入NH3、冷冻、加食盐,其中通入NH3的作用一_______________________________,作用二_______________________________。
(5)工业生产的纯碱常会含少量NaCl杂质。现用重量法测定其纯度,步骤如下:
① 称取样品ag,加水溶解;
② 加入足量的BaCl2溶液;
③ 过滤、_________、烘干、冷却、称量、烘干、冷却、_________,最终得到固体bg。样品中纯碱的质量分数为___________________(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、氧和铝是地球上极为丰富的元素。请回答下列问题:
(1)X+中所有电子恰好充满K、L、M3个电子层。
①X+与N3-形成的晶体结构如图所示。X原子的原子序数是____;基态N3-的电子排布式为______;与N3-等距离且最近的X+有______个。

②X2+和Zn2+分别可与NH3形成[X(NH3)4]2+、[Zn(NH3)4]2+,两种配离子中提供孤电子对的原子均为_______(写元素名称)。已知两种配离子都具有对称的空间构型,[Zn(NH3)4]2+中的两个NH3被两个Cl-取代只能得到一种结构的产物,而[X(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种结构不同的产物,则[X(NH3)4]2+的空间构型为_______;[Zn(NH3)4]2+中Zn的杂化类型为_______________。
(2)铝的最高价氧化物的水化物有两性,根据对角线规则写出BeO与NaOH溶液反应的离子方程式_____________________________。次碘酸也有两性,写出次碘酸与盐酸反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关晶体的叙述中,不正确的是 ( )
A. 氯化铯晶体中,每个Cs+周围紧邻8个Cl-
B. 金刚石为网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子
C. 金属铜属于六方最密堆积结构,金属镁属于面心立方最密堆积结构
D. 干冰晶体中,每个CO2分子周围紧邻12个CO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是( )
A.加热
B.将稀硫酸改成98%的浓硫酸
C.滴加少量CuSO4溶液
D.不用铁片,改用铁粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com