
【题目】1000mL某待测液中除含有0.2molL﹣1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl﹣、Br﹣、CO32﹣、HCO3﹣、SO32﹣、SO42﹣ |
现进行如下实验操作(每次实验所加试剂均过量): 
(1)写出生成白色沉淀B的离子方程式: .
(2)待测液中肯定不存在的阳离子是 .
(3)若无色气体D是单一气体:
阴离子 | Cl﹣ | Br﹣ | CO32﹣ | HCO3﹣ | SO32﹣ | SO42﹣ |
浓度/molL﹣1 |
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由: .
(4)若无色气体D是混合气体: ①待测液中一定含有的阴离子是 .
②沉淀A中能与稀硝酸反应的成分是(写化学式).
【答案】
(1)HCO3﹣+Ba2++OH﹣=BaCO3↓+H2O
(2)Fe3+、Ba2+
(3)存在,K+离子最小浓度为0.1mol/L
(4)CO32﹣、HCO3﹣、SO32﹣;BaCO3、BaSO3
【解析】解:待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO32﹣、SO32﹣、SO42﹣ , 向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO32﹣ , 可能存在SO32﹣、SO42﹣中的两种或一种,根据离子共存知,溶液中不存在Ba2+; 滤液A中有Ba2+ , 加入过量的NaOH溶液得到气体B、白色沉淀B,则溶液中一定含有NH4+、HCO3﹣ , 一定不存在Fe3+ , 气体B为NH3 , 白色沉淀B为BaCO3 , 滤液B中通入氯气,得浅黄绿色溶液,溶液中一定没有Br﹣ , 滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明滤液B中含有Cl﹣ , 由于加入氯化钡溶液,不能确定原溶液中是否含有Cl﹣;(1)由上述分析可知,白色沉淀B为碳酸钡,是由HCO3﹣、Ba2+、OH﹣反应生成,反应离子方程式为:HCO3﹣+Ba2++OH﹣=BaCO3↓+H2O,
所以答案是:HCO3﹣+Ba2++OH﹣=BaCO3↓+H2O;(2)由上述分析可知,溶液中一定没有的阳离子是:Fe3+、Ba2+ ,
所以答案是:Fe3+、Ba2+;(3)①由上述分析可知,不能确定原溶液中是否含有Cl﹣ , 溶液中一定没有Br﹣ .
若无色气体D是单一气体,则D为CO2 , E为CaCO3 , 溶液中含有CO32﹣ , 白色沉淀D只能为BaSO4 , 溶液中一定没有SO32﹣ , 一定含有SO42﹣ ,
B(碳酸钡)的物质的量= ![]() =0.1mol,则n(HCO3﹣)=0.1mol,故c(HCO3﹣)=
=0.1mol,则n(HCO3﹣)=0.1mol,故c(HCO3﹣)= ![]() =0.1mol/L,
=0.1mol/L,
E(碳酸钙)的物质的量= ![]() =0.1mol,则n(CO32﹣)=0.1mol,故c(CO32﹣)=
=0.1mol,则n(CO32﹣)=0.1mol,故c(CO32﹣)= ![]() =0.1mol/L,
=0.1mol/L,
D(硫酸钡)的物质的量= ![]() =0.05mol,则n(SO42﹣)=0.05mol,故c(SO42﹣)=
=0.05mol,则n(SO42﹣)=0.05mol,故c(SO42﹣)= ![]() =0.05mol/L,
=0.05mol/L,
所以答案是:
阴离子 | Cl﹣ | Br﹣ | CO32﹣ | HCO3﹣ | SO32﹣ | SO42﹣ |
浓度/molL﹣1 | ? | 0 | 0.1 | 0.1 | 0 | 0.05 |
②n(NH4+)=n(NH3)= ![]() =0.1mol,则c(NH4+)=0.1mol/L,溶液中c(Na+)=0.2mol/L,c(HCO3﹣)=0.1mol/L,c(CO32﹣)=0.1mol/L,c(SO42﹣)=0.05mol/L,单位体积为正电荷=1×0.1mol/L+1×0.2mol/L=0.3mol/L,单位体积内负电荷=1×0.1mol/L+2×0.1mol/L+2×0.05mol/L=0.4mol/L,则单位体积为正电荷<单位体积内负电荷,故一定含有K+ , 当溶液中没有Cl﹣ , K+离子浓度最小,根据电荷守恒可知,c(K+)最小浓度=0.4mol/L﹣0.3mol.L=0.1mol/L,
=0.1mol,则c(NH4+)=0.1mol/L,溶液中c(Na+)=0.2mol/L,c(HCO3﹣)=0.1mol/L,c(CO32﹣)=0.1mol/L,c(SO42﹣)=0.05mol/L,单位体积为正电荷=1×0.1mol/L+1×0.2mol/L=0.3mol/L,单位体积内负电荷=1×0.1mol/L+2×0.1mol/L+2×0.05mol/L=0.4mol/L,则单位体积为正电荷<单位体积内负电荷,故一定含有K+ , 当溶液中没有Cl﹣ , K+离子浓度最小,根据电荷守恒可知,c(K+)最小浓度=0.4mol/L﹣0.3mol.L=0.1mol/L,
所以答案是:存在;K+离子最小浓度为0.1mol/L;(4)由上述分析可知,溶液中一定含有CO32﹣、HCO3﹣ , 不能确定原溶液中是否含有Cl﹣ , 溶液中一定没有Br﹣ .
若无色气体D是混合气体,只能为CO2、NO混合气体,白色沉淀D只能为BaSO4 , 溶液中一定含有SO32﹣ , 不能确定是否含有SO42﹣ , 沉淀A中一定含有BaCO3 , BaSO3 ,
①待测液中一定含有的阴离子是CO32﹣、HCO3﹣、SO32﹣ , 所以答案是:CO32﹣、HCO3﹣、SO32﹣;
②沉淀A中BaCO3 , BaSO3能与稀硝酸反应,所以答案是:BaCO3、BaSO3 .


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】实验室准备较快地制取氢气,可采用的方法是
A.用纯锌与稀硫酸反应
B.用粗锌与稀硫酸反应
C.用粗锌与稀硝酸反应
D.在CuSO4溶液中浸泡过的纯锌与稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组利用图1装置探究SO2的性质.
请回答下列问题:
(1)装置甲中A仪器的名称是 .
(2)装置乙中出现的现象是 , 可以证明SO2具有(填代号).装置丙中发生反应的化学方程式为 , 可以证明SO2具有(填代号).
a.氧化性 b.还原性 c.漂自性
(3)收集SO2气体可以选择的装置如图2为(填代号).从环保的角度考虑,收集装置的出气口需要连接一个盛有(填化学式)溶液的洗气瓶.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】F、G均是常见的香料,可通过下列途径合成,合成路线如图: 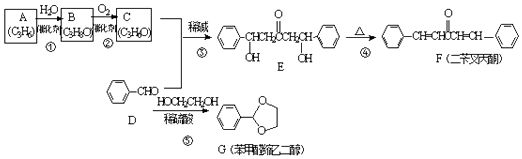
回答下列问题
(1)B的名称为 .
(2)③的反应类型是;④的反应类型是 .
(3)C的结构简式是;A加聚产物的结构简式是 .
(4)F分子中位于同一平面的碳原子最多有个.
(5)G的芳香同分异构体中且能发生银镜反应和水解反应的异构体有种,其中核磁共振氢谱只有四组峰的异构体结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是在人类文明发展过程中起了重要作用的元素。下列有关硅的说法正确的是( )
A. 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
B. 硅在自然界中有单质存在
C. 光纤通信是以光作为信息的载体,光导纤维的主要成分是SiO2
D. 硅单质的性质十分稳定,不能和任何物质发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用标准的盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是( )
A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C.用碱式滴定管取10.00 mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定
D.用酚酞作指示剂滴至红色刚变无色时即停止加盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①5Cl2+I2+6H2O=2HIO3+10HCl
② ![]() +5Cl+6H+=3Cl2↑+3H2O
+5Cl+6H+=3Cl2↑+3H2O
下列按物质氧化性顺序由强到弱排列正确的是( )
A.Cl2> ![]() >
> ![]()
B.![]() >Cl2>
>Cl2> ![]()
C.![]() >
> ![]() >Cl2
>Cl2
D.Cl2> ![]() >
> ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,抽去如图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是(设NA表示阿伏加德罗常数的值)( ) 
A.反应前气体的总体积为0.448L
B.装置中氢元素的总质量为0.04g
C.生成物中含有0.01NA个分子
D.生成物完全溶于水后所得溶液含有0.01 NA个NH4+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com