
| ||

| ||
| ||


科目:高中化学 来源: 题型:
| A、Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(H+) |
| B、Na2CO3溶液中:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) |
| C、加入少量NaOH固体,水解平衡左移,溶液pH增大 |
| D、稀释该溶液,溶液中c(H+)和c(OH-)都减少,KW减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-+H2O?CO32-+H3O+ |
| B、HCO3-+H2O?H2CO3+OH- |
| C、HCO3-+OH-?CO32-+H2O |
| D、CO32-+H+=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
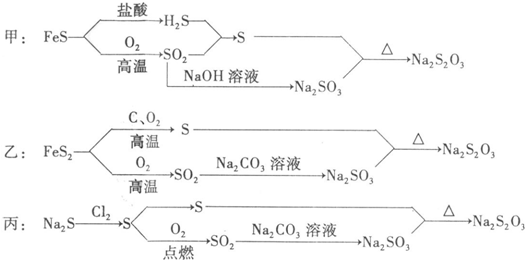
查看答案和解析>>
科目:高中化学 来源: 题型:
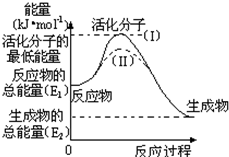 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察图,然后回答问题.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 乙烯、苯是两种来自石油和煤的基本化工原料;乙醇和乙酸是两种生活中常见的有机化合物.
乙烯、苯是两种来自石油和煤的基本化工原料;乙醇和乙酸是两种生活中常见的有机化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
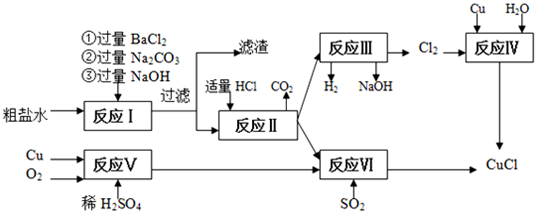
查看答案和解析>>
科目:高中化学 来源: 题型:
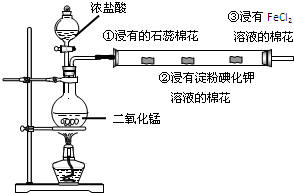 某同学利用下图装置,研究氯气的性质.请据图回答:
某同学利用下图装置,研究氯气的性质.请据图回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com