
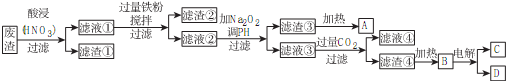
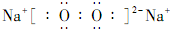 .
.分析 废渣加入硝酸酸浸,过滤得到滤渣①为BaSO4,滤液①含有Al3+、Fe3+、Cu2+、Ag+,加入过量铁粉,充分搅拌、过滤,滤渣②含有Cu、Ag、Fe等,滤液②含有Al3+、Fe2+,加入过氧化钠调节pH,得到滤渣③为Fe(OH)3,加热分解生成A为Fe2O3,滤液③主要成分为NaAlO2,通入过量二氧化碳生成滤渣④为Al(OH)3,分解生成Al2O3,熔融态的Al2O3电解生成铝单质和氧气,滤液④含有NaHCO3,以此解答该题.
解答 解:废渣加入硝酸酸浸,过滤得到滤渣①为BaSO4,滤液①含有Al3+、Fe3+、Cu2+、Ag+,加入过量铁粉,充分搅拌、过滤,滤渣②含有Cu、Ag、Fe等,滤液②含有Al3+、Fe2+,加入过氧化钠调节pH,得到滤渣③为Fe(OH)3,加热分解生成A为Fe2O3,滤液③主要成分为NaAlO2,通入过量二氧化碳生成滤渣④为Al(OH)3,分解生成Al2O3,熔融态的Al2O3电解生成铝单质和氧气,滤液④含有NaHCO3,
(1)滤渣①为BaSO4,不溶于稀硝酸,是离子化合物,溶解的部分,完全电离,属于强电解质,故答案为:BaSO4;强;
(2)加入过量铁粉,被还原的金属阳离子有Fe3+、Cu2+、Ag+,过氧化钠是离子化合物,既有离子键,又有共价键,电子式为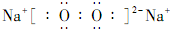 ,
,
故答案为:Fe3+、Cu2+、Ag+;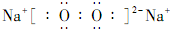 .
.
(3)滤渣②中有铜和银.粗铜(含有银)作阳极,用硫酸铜作电解质溶液,阳极铜溶解,银在阳极泥析出,铜在阴极析出,故答案为:阳;银;
(4)通入过量的二氧化碳,生成的是NaHCO3和Al(OH)3,Al(OH)3受热分解生成Al2O3,熔融态的Al2O3电解生成铝单质和氧气,方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,
故答案为:NaHCO3;2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;
(5)过氧化钠将滤液②中Fe氧化为Fe,滤渣③为Fe(OH)3,Fe(OH)3受热分解,失水生成红棕色的Fe2O3,方程式为2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,
故答案为:2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O.
点评 本题以工艺流程题形式考查元素化合物的性质、物质的分离提纯、化学用语书写等,为高频考点和常见题型,侧重于学生的分析能力和实验能力的考查,题目有利于培养学生良好的科学素养,难度中等,清楚工艺流程原理是关键,是对知识迁移的综合运用.


科目:高中化学 来源: 题型:选择题
| A. | X、W、U的最高价氧化物对应的水化物酸性由强到弱的顺序为:U>W>X | |
| B. | Y、Z元素的单质作电极,在氢氧化钠溶液中构成原电池,Z电极上产生大量气泡 | |
| C. | 室温下,0.05.mol•L-1U的气态氢化物的水溶液的pH>1 | |
| D. | Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
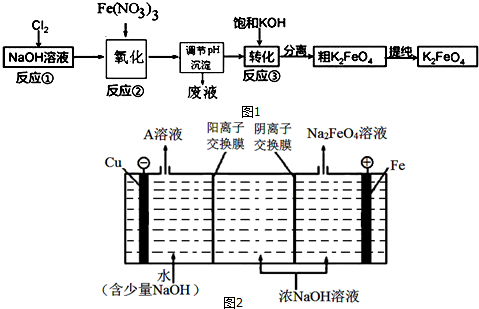
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 根据上表,向足量NaClO溶液中通入CO2:CO2+H2O+2ClOˉ═2HClO+CO32- | |
| B. | 向上述 NaClO溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>c(HClO) | |
| C. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| D. | 若将CO2通入0.1mol•L-1Na2CO3溶液中至溶液中性,则溶液中2c(CO32-)+c (HCO3-)=0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验溴乙烷中的溴:取溴乙烷加氢氧化钠溶液,加热,再加硝酸银溶液有浅黄色沉淀生成 | |
| B. | 检验葡萄糖:在硝酸银溶液中滴加稀氨水至沉淀恰好溶解再加少许葡萄糖溶液,水浴加热 | |
| C. | 检验乙醛:加入2% 硫酸铜溶液2 mL再加入2% NaOH溶液2 mL;加热至沸腾 | |
| D. | 实验室制乙烯:取浓硫酸和乙醇体积比1:3的溶液加热到170℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
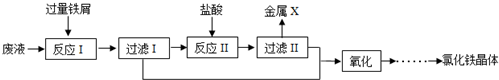
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
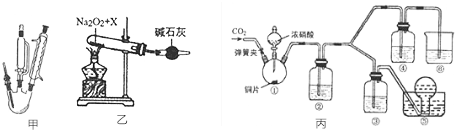
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯为纯净物;聚乙烯为混合物 | |
| B. | 等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 | |
| C. | 乙烯的化学性质比聚乙烯活泼 | |
| D. | 乙烯和聚乙烯都能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com