
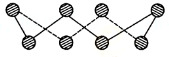
 VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途.请回答下列问题:
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途.请回答下列问题:分析 (1)根据图片知,每个S原子含有2个σ键和2个孤电子对,根据价层电子对互斥理论确定S原子杂化方式;
(2)同一主族元素,元素原子失电子能力随着原子序数的增大而增强,原子失电子能力越强,其第一电离能越小;
(3)Se元素34号元素,M电子层上有18个电子,分别位于3s、3p、3d能级上;
(4)非金属性越强的元素,其与氢元素的结合能力越强,则其氢化物在水溶液中就越难电离,酸性就越弱;
根据价层电子对互斥理论确定气态SeO3分子的立体构型、SO32-离子的立体构型;
(5)①酸第一步电离产生的酸根阴离子带有负电荷,由于异种电荷相互吸引,第一步产生的H+抑制第二步电离;
②H2SeO3的分子结构为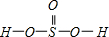 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为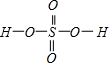 ,Se为+6价,后者Se原子吸电子能力强.
,Se为+6价,后者Se原子吸电子能力强.
解答 解:(1)根据图片知,每个S原子含有2个σ键和2个孤电子对,所以每个S原子的价层电子对个数是4,则S原子为sp3杂化,
故答案为:sp3;
(2)同一主族元素,元素原子失电子能力随着原子序数的增大而增强,原子失电子能力越强,其第一电离能越小,所以其第一电离能大小顺序是O>S>Se,
故答案为:O>S>Se;
(3)Se元素34号元素,M电子层上有18个电子,分别位于3s、3p、3d能级上,所以其核外M层电子的排布式为3s23p63d10,
故答案为:34;3s23p63d10;
(4)非金属性越强的元素,其与氢元素的结合能力越强,则其氢化物在水溶液中就越难电离,酸性就越弱,非金属性S>Se,所以H2Se的酸性比H2S强,气态SeO3分子中Se原子价层电子对个数是3且不含孤电子对,所以其立体构型为平面三角形,SO32-离子中S原子价层电子对个数=3+$\frac{1}{2}$(6+2-3×2)=4且含有一个孤电子对,所以其立体构型为三角锥形,
故答案为:强;平面三角形;三角锥形;
(5)①酸第一步电离产生的酸根阴离子带有负电荷,吸引H+,同时产生的H+抑制第二步电离,所以H2SeO4和H2SeO3第一步电离程度大于第二部电离程度,导致第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子,
故答案为:第一步产生的H+抑制第二步电离;第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子;
②H2SeO3的分子结构为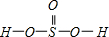 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为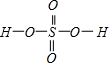 ,Se为+6价,后者Se原子吸电子能力强,导致Se-O-H中的O原子更向Se偏移,则羟基上氢原子更容易电离出H+,
,Se为+6价,后者Se原子吸电子能力强,导致Se-O-H中的O原子更向Se偏移,则羟基上氢原子更容易电离出H+,
故答案为:H2SeO3和H2SeO4可表示为 (HO)SeO2和 (HO)2SeO2.H2SeO3中Se为+4价,而H2SeO4中Se为+6价,正电性更高,导致Se-O-H中的O原子更向Se偏移,越易电离出H+.
点评 本题考查了较综合,涉及粒子空间构型判断、原子杂化方式判断、元素周期律等知识点,这些知识点都是高考高频点,根据价层电子对互斥理论、元素周期律等知识点来分析解答,注意(4)氢化物酸性强弱比较方法,为易错点,(5)注意把握含氧酸酸性强弱的判断方法.


科目:高中化学 来源: 题型:选择题
| A. | 硫原子的结构示意图: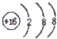 | B. | Na2S的电子式:Na+: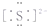 | ||
| C. | HCl的结构式:H-Cl | D. | CH4分子的球模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
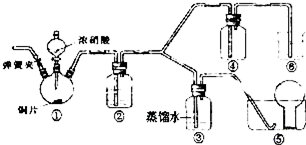
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
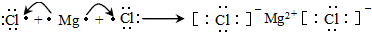 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,在pH=7的醋酸钠和醋酸混合溶液中:c(CH3COO-)>c(Na+) | |
| B. | 1 mol•L-1的硫化钠溶液中,c(H+)+c(Na+)=c(OH-)+c(HS-)+c(S2-) | |
| C. | 稀释醋酸溶液,溶液中所有离子的浓度均降低 | |
| D. | pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 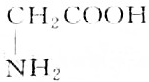 | B. | 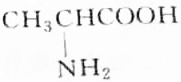 | ||
| C. | 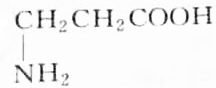 | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com