
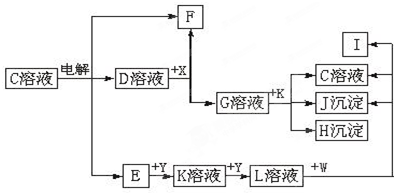


科目:高中化学 来源: 题型:
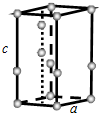
查看答案和解析>>
科目:高中化学 来源: 题型:
| 硫酸 化学纯(CP)(500mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84g?cm-3 质量分数:98% |
查看答案和解析>>
科目:高中化学 来源: 题型:
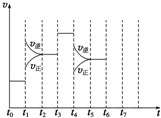 在一密闭容器中发生反应N2+3H2?2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2+3H2?2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
 用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积).
用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
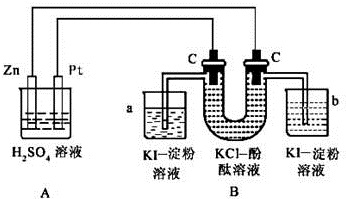
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com