
| A.观察法 | B.分类法 | C.实验法 | D.比较法 |
科目:高中化学 来源:不详 题型:问答题
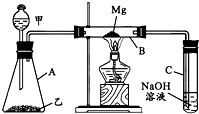
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
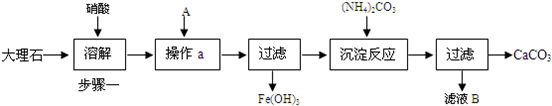
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
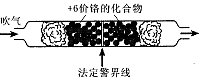
 Cr2O72-+H2O在酸性条件下+6价铬化合物具有强氧化性,可以将C2H5OH氧化为CH3COOH,本身被还原为Cr3+,Cr3+在水溶液中呈灰绿色。
Cr2O72-+H2O在酸性条件下+6价铬化合物具有强氧化性,可以将C2H5OH氧化为CH3COOH,本身被还原为Cr3+,Cr3+在水溶液中呈灰绿色。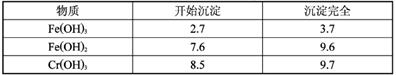
| A.反应中发生转移的电子个数为3nx |
| B.该废水中c(Cr2O2-7)为50nx mol/L |
| C.消耗硫酸亚铁铵的物质的量为n(l+y)mol |
| D.在FeO·FeyCrxO3中,x+y=2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.分液时,分液漏斗下层液体从下端放出,上层液体从上口倒出 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.蒸发结晶时应将溶液直接蒸干 |
| D.称量非腐蚀性药品应放在托盘天平左盘的称量纸上,砝码放在托盘天平右盘的称量纸上 |
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ② | Mg产生气泡速率快于Fe,Cu无明显变化 | 金属性质越活泼,反应速率越快 |
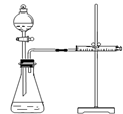
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
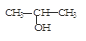 与NaOH的醇溶液共热制备CH3—CH═CH2
与NaOH的醇溶液共热制备CH3—CH═CH2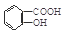 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备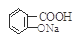
| A.只有① | B.只有①④ | C.只有①③④ | D.都不能 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
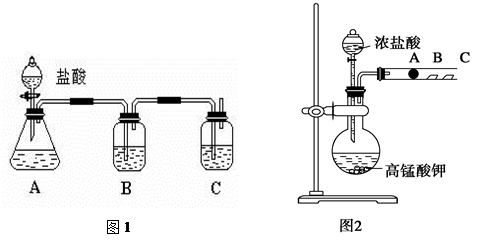
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | 供选择试剂 |
| Fe3+ | 1.9 | 3.7 | A.氯水, B.H2O2, C.NaOH, D.氨水, E.CuO, F.Cu2(OH)2CO3 |
| Fe2+ | 7.5 | 11 | |
| Cu2+ | 6.0 | 10 |
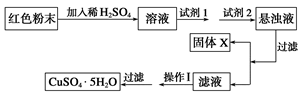
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
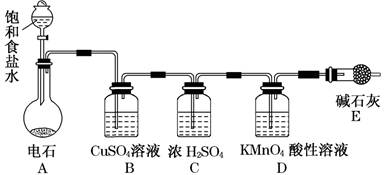
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com