
【题目】某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。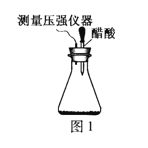
(1)请完成以下实验设计表(表中不要留空格):
编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
② | 醋酸浓度的影响 | 0.5 | ______ | 36.0 |
③ | _________ | 0.2 | 2.0 | 90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了______腐蚀,负极的电极反应式为______。请在图3中用箭头标出发生该腐蚀时电子流动方向______;此时,碳粉表面发生了______(“氧化”或“还原”)反应。
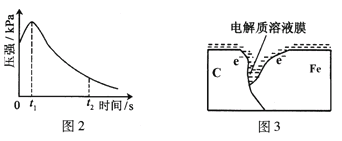
(3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:___________________。
【答案】 2.0 碳粉质量的影响 吸氧 Fe-2e-=Fe2+ 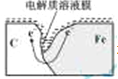 还原 反应放热,温度升高使气压变大
还原 反应放热,温度升高使气压变大
【解析】(1)探究影响化学反应速率,采用控制变量法,每次只能改变一个变量,故有②中铁的量不变,为2.0g;③中改变了碳粉的质量,故为探究碳粉的量对速率的影响。
(2)压强与气体的物质的量成正比,从图中可以看出,气体的量开始增加,后减少,故为吸氧腐蚀,活泼金属做负极,负极的电极反应式为:Fe-2e-=Fe2+,腐蚀时电子流动方向是负极流正极,如图所示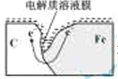 ;碳为正极,故碳粉表面发生还原反应。
;碳为正极,故碳粉表面发生还原反应。
(3)基于图中0~t1时压强变大,可能是产生气体或单位时间速率加快,或是气体受热膨胀等原因分析,假设一是产生氢气,假设二则可能是反应放热,温度升高,体积增大。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_________________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是_____________________。
②将下列实验操作步骤正确排序__________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=__________(列式表示)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C中盛有BaCl2溶液,观察到C中有白色沉淀生成,D中所盛的试剂___________及观察到的现象为________。
②写出硫酸亚铁高温分解反应的化学方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的( )
A.2Na2O2+2H2O=4NaOH+O2↑
B.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
C.Cl2+H2O=HClO+HCl
D.NH4Cl+NaOH ![]() NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新制氯水与久置的氯水相比较,下列结论不正确的是
A. 颜色相同 B. 前者能使有色布条褪色
C. 都含有H+ D. 加AgNO3溶液都能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有大量的H+和SO42-,则此溶液还能大量存在的离子组是
A. Na+、Fe2+、NO3- B. Na+、Mg2+、NO3-
C. Cr2O72-、Ba2+、Cl- D. K+、Na+、S2O32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2被称为绿色氧化剂,受到人们越来越多的关注。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请问答下列问题:
(1)定性分析:图甲可通过观察____________,定性比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液更合理,其理由是_____________。

(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为_________,检查该装置气密性的方法是:关闭分液漏斗的活塞,将注射器活塞向外拉出一段后松手,过一段时间后看________,实验中需要测量的数据是_______。

(3)课本在研究浓度对反应速率影响的实验中,酸性高锰酸钾和草酸反应的离子方程式为________,反应开始一段时间后反应速率明显提升的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素A、B、C、D的原子序数依次增加。甲、丙、戊是由这些元素组成的二元化合物,丙分子中原子个数比为1:1,乙是元素D的单质,通常为深红棕色液体,丁为淡黄色固体,0.01 mol/L戊溶液的pH为2,己为难溶于水、密度比水大的油状物。上述物质的转化关系如图所示。下列说法中不正确的是

A. 四种元素既不同周期也不同主族
B. 元素的非金属性A<B<C
C. 丙常温常压下为气态
D. C的最高价氧化物对应的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系.已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体,C呈黄绿色;化合物F是淡黄色固体,化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;D和E的反应是化工生产中的一种重要的固氮反应. 
请回答下列问题:
①E 和J的电子式分别是和 .
②写出F和CO2反应的化学方程式并用单线桥法表示电子转移的情况
③将少量单质C通入盛有淀粉碘化钾溶液的试管中,溶液变蓝色,该反应的离子方程式为 .
④标况下3.36L气体B与A完全反应,转移电子的数目为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com