
| A. | pH=6的NaHSO4溶液:c(Na+)+c(H+)=2c(SO42-)+c(OH-) | |
| B. | 0.1 mol/L NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积不变 | |
| C. | pH相同的①CH3COONa、②NaClO二种溶液的c(Na+):①<② | |
| D. | 0.1 mol/L Na2SO3溶液:c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3) |
分析 A.根据电荷守恒分析;
B.c(H+)与c(OH-)的乘积为Kw,Kw只与温度有关;
C.NaClO的水解程度大于CH3COONa,pH相同时,NaClO的浓度较小;
D.根据物料守恒分析.
解答 解:A.pH=6的NaHSO4溶液阴离子所带负电荷总数等于阳离子所带正电荷总数,则:c(Na+)+c(H+)=2c(SO42-)+c(OH-),故A正确;
B.c(H+)与c(OH-)的乘积为Kw,Kw只与温度有关,所以0.1 mol/L NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积不变,故B正确;
C.NaClO的水解程度大于CH3COONa,pH相同时,NaClO的浓度较小,则二种溶液的c(Na+):①>②,故C错误;
D.0.1 mol/L Na2SO3溶液中Na的总浓度等于S的总浓度的2倍,则:c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3),故D正确.
故选C.
点评 本题考查离子浓度大小比较,题目难度中等,本题注意根据题目信息判断,反应后溶质的量及电离、水解的大小,结合电荷守恒和物料守恒解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 工业用焦炭在高温下还原二氧化硅制得高纯硅 | |
| B. | SiO2可用于制造光导纤维 | |
| C. | 钠是一种强还原剂,可以把钛、锆、铌等从其熔融盐中置换出来 | |
| D. | 氧化镁熔点高达250℃,是优质的耐高温材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol•L-1 | B. | 0.05mol•L-1 | C. | 0.017mol•L-1 | D. | 0.50mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
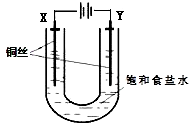 已知:Ksp(CuCl,白色)=1.2×10-6,Ksp(CuOH,橙黄色)=1.2×10-14.如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-═CuCl.下列说法不正确的是( )
已知:Ksp(CuCl,白色)=1.2×10-6,Ksp(CuOH,橙黄色)=1.2×10-14.如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-═CuCl.下列说法不正确的是( )| A. | Y极发生的电极反应2H2O+2e-═2OH-+H2↑ | |
| B. | 实验开始时,X极附近出现白色浑浊 | |
| C. | 一段时间后,U形管底部形成橙黄色沉淀 | |
| D. | 电解时,Cl-移向Y极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ③④⑤⑥ | C. | ②④⑥ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Al3+ | B. | Fe3+ | C. | Fe2+、NH4+ | D. | Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )| A. | 它的系统名称是2,4-二甲基-4-戊烯 | |
| B. | 它的分子中最多有5个碳原子在同一平面上 | |
| C. | 它与甲基环己烷互为同分异构体 | |
| D. | 有机物的一氯取代产物共有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三个烧杯中一定均会发生的离子反应有:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 三个烧杯中钠均在液面上剧烈反应 | |
| C. | Z烧杯中一定会有沉淀生成,但沉淀不是单质铜 | |
| D. | 三个烧杯中生成氢气的物质的量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com