
 作为高中生,学会利用我们课堂上学到的知识来解决生活中的一些问题,是我们学习的重要目的之一.某中学的化学实验兴趣小组,一行四人,利用实验室老师提供的基本仪器和药品,自行购置了鸡蛋,食醋等生活用品,进行了如下探究.
作为高中生,学会利用我们课堂上学到的知识来解决生活中的一些问题,是我们学习的重要目的之一.某中学的化学实验兴趣小组,一行四人,利用实验室老师提供的基本仪器和药品,自行购置了鸡蛋,食醋等生活用品,进行了如下探究.分析 Ⅰ、(1)食醋的物质的量浓度为0.7mol•L-1,总酸量为0.75mol•L-1×60g/mol=45g/L;
(2)醋酸与碳酸钙反应生成醋酸钙和二氧化碳和水;
Ⅱ、(1)根据配制一定物质的量浓度的溶液的步骤是计算、量取、稀释、移液、洗涤、定容、摇匀选择合适的仪器;
(2)求出浓盐酸的物质的量浓度c=$\frac{1000ρω}{M}$,然后根据稀释定律C浓V浓=C稀V稀来计算;
(3)根据c=$\frac{n}{V}$,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差;
Ⅲ、胶体遇电解质溶液发生聚沉;
解答 解:Ⅰ、(1)食醋的物质的量浓度为0.75mol•L-1,总酸量为0.75mol•L-1×60g/mol=45g/L,即4.50g/100mL,为酿造醋,
故答案为:4.50;酿造;
(2)醋酸与碳酸钙反应生成醋酸钙和二氧化碳和水,反应的离子方程式:2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2O;
故答案为:2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2O;
Ⅱ、(1)根据配制一定物质的量浓度的溶液的步骤是计算、量取、稀释、移液、洗涤、定容、摇匀可知需要的仪器有:量筒、烧杯、玻璃棒、100mL容量瓶和胶头滴管,故需要选用的仪器有①③⑤⑦,还缺少的仪器有100mL容量瓶,
故答案为:100mL容量瓶;
(2)浓盐酸的物质的量浓度c=$\frac{1000×1.18×36.5%}{36.5}$mol/L=11.8mol/L,设需要的浓盐酸的体积为VmL,然后根据稀释定律c浓V浓=c稀V稀可知:
11.8mol/L×VmL=100mL×1mol•L-1,解得V=8.5mL,
故答案为:8.5;
( 3 )A.定容时俯视容量瓶刻度线,会导致溶液体积偏小,则浓度偏高,故A错误;
B.容量瓶在使用前未干燥,里面有少量蒸馏水,对浓度无影响,故B错误;
C.转移溶液后,未洗涤烧杯和玻璃棒,会导致溶质的损失,则浓度偏低,故C正确;
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线,则溶液体积增加,所配浓度偏小,故D正确;
故答案为:CD;
Ⅲ、胶体和电解质混合可以聚沉.盐酸是电解质氯化氢的水溶液,所以将配制好的盐酸溶液加入到鸡蛋清溶液中,会出现絮状沉淀,此现象称为胶体的聚沉,
故答案为:胶体的聚沉.
点评 本题考查了性质实验方案的设计,题目难度中等,涉及配置一定物质的量浓度的溶液方法及误差分析、化学计算、胶体的性质、离子方程式书写等知识,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验、进行计算能力.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 升高温度可增大单位体积活化分子数百分数,促进有效碰撞,从而提高反应速率 | |
| B. | 增大体系压强可增大单位体积活化分子数,促进有效碰撞,从而提高反应速率 | |
| C. | 放热反应(△H<0)和熵增(△S>0)反应一定能自发反应 | |
| D. | 由能量守恒可知任何放热反应都可设计成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | |||
| X | Y | Z |
| A. | 原子半径大小:X>Y>Z | |
| B. | W、Y两种元素都能与氧元素形成化合物WO2、YO2 | |
| C. | 最高价氧化物对应水化物的酸性:W>Y>Z | |
| D. | W元素的单质能从X的氧化物中置换出X单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①比②多 | B. | ②比①多 | C. | 一样多 | D. | 无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从海水中可提取镁,电解熔融氯化镁可制得金属镁 | |
| B. | 应用高纯度单质硅制成光导纤维,提高信息传输速度 | |
| C. | 研制高性能的耐磨轮胎,可减少PM2.5等细颗粒物的产生 | |
| D. | 开发二氧化碳制成的全降解塑料,缓解日益严重的“白色污染” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
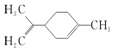
| A. | 它的一氯代物有6种 | |
| B. | 它分子式为:C10H18 | |
| C. | 它的分子中所有的碳原子一定在同一平面上 | |
| D. | 一定条件下,它分别可以发生加成、取代、氧化、加聚等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的硅单质广泛用于制作光导纤维 | |
| B. | 绚丽缤纷的烟花中添加了含钾、钙、钠、铜等金属元素的化合物 | |
| C. | 汽车尾气中氮氧化物的产生主要是由于汽油中含有氮元素 | |
| D. | 埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com