
(16分)2014年3月22日是第二十二届“世界水日”,保护水资源,从我做起!
(1)ClO2和Cl2(还原产物都为Cl-)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的_______倍。
(2)炼金废水中含有络离子[Au(CN)2]+,与弱电解质碳酸的电离方式相似,[Au(CN)2]+也存在着两步电离,其电离出CN-有毒,CN-与H+结合生成毒性更强的HCN。 [Au(CN)2]+的一级电离方程式: ;在碱性条件下NaClO将废水中的CN-氧化成CO和N2,其反应的离子方程式为: 。
(3)某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-离子中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关现象如下图所示:

请根据上图回答下列问题:
①实验中需配制1.0mol/L的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为________________。
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为_________________ ___。
③试确定NO3-是否存在?_________________(填“存在”、“不存在”或“不确定”),若存在,试计算 _________________(若不存在,此问不必作答)。
_________________(若不存在,此问不必作答)。
(4)聚合硫酸铁又称聚铁,其化学式为[Fe2(OH)n(SO4)(3―0.5n)]m(n>2,m≤10),它是一种高效的无机高分子混凝剂、净水剂。 某中学化学兴趣小组查资料获取测定聚铁中含铁量的方法:把聚铁溶于过量酸中,先用过量SnCl2将Fe3+还原成 Fe2+:Sn2+ + 2Fe3+ + 6Cl-= 2Fe2+ + SnCl62-,再加入HgCl2溶液除去过量的SnCl2:Sn2+ + 2Hg2+ + 8Cl- = Hg2Cl2↓+ SnCl62-,然后用标准的K2Cr2O7溶液(先加入几滴试亚铁灵指示剂)滴定溶液中的Fe2+。若称取聚铁质量为10.00g配成100.0 mL溶液,取出20.00 mL,经上述方法处理后,再用0.1000 mol·L—1K2Cr2O7标准溶液滴定,达到终点时,消耗标准溶液12.80 mL,则聚铁中铁元素的质量分数为 %。(保留小数点后一位)
(1) 2.5 ;
(2) [Au(CN)2]+ [Au(CN)]2++CN- ; 5ClO-+2CN-+2OH-===2CO
[Au(CN)]2++CN- ; 5ClO-+2CN-+2OH-===2CO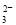 +N2↑+5Cl-+H2O
+N2↑+5Cl-+H2O
(3) 100mL容量瓶 ;Al(OH)3+OH-===AlO2-+2H2O; 存在 ;c(NO3-) =0.15 mol/L;(4)21.5% 。
【解析】
试题分析:(1)ClO2中Cl的化合价是+4价,反应时每1mol可以得到5mol的电子。而Cl2中Cl的化合价为0价,每1mol可以得到2mol的电子。所以当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的5÷2=2.5倍;(2)[Au(CN)2]+的一级电离方程式:[Au(CN)2]+ [Au(CN)]2++CN-;在碱性条件下NaClO将废水中的CN-氧化成CO
[Au(CN)]2++CN-;在碱性条件下NaClO将废水中的CN-氧化成CO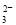 和N2,根据氧化还原反应中电子转移数目相等可知该反应的离子方程式为5ClO-+2CN-+2OH-=2CO
和N2,根据氧化还原反应中电子转移数目相等可知该反应的离子方程式为5ClO-+2CN-+2OH-=2CO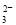 +N2↑+5Cl-+H2O;(3)①实验中需配制1.0mol/L的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为100ml的容量瓶;②实验③中沉淀量由A→B过程中是Al(OH)3被过量的NaOH溶解的反应所致,所发生反应的离子方程式为Al(OH)3+OH-===AlO2-+2H2O;③在100ml的溶液中,焰色反应为黄色,只能含有Na+;向其中加入BaCl2溶液和稀HCl,产生白色沉淀2.33g,证明含有SO42-,其物质的量是2.33g÷233g/mol=0.01mol;向该溶液中加入过量的NaOH溶液,产生白色沉淀,就证明不含有Fe3+,当沉淀达到最大值后沉淀有有所减小,最后还存在沉淀,证明含有Al3+、Mg2+,由于Al3+、Mg2+与CO32-会发生离子反应而不能大量共存,所以不存在CO32-;根据反应方程式:Al3++3OH-=Al(OH)3↓; Mg2++2OH-=Mg(OH)2↓. Al(OH)3+ OH-= AlO2-+ 2H2O.结合图像给出消耗NaOH的物质的量的关系可知:n(Al3+)=0.005mol;n(Mg2+)=(0.035mol-0.005mol×2)÷2=0.01mol。根据电荷守恒可知:Al3+、Mg2+所带的正电荷数是:0.005mol×3+0.01mol×2=0.035mol,溶液中还存在阳离子Na+,而SO42-所带的负电荷数是0.01mol×2=0.02mol,负电荷数小于正电荷数,CO32-不存在,所以一定还存在NO3-。NO3-的浓度可能是:(0.035mol-0.02mol)÷0.1L=0.15 mol/L. (4)根据氧化还原反应中电子转移数目相等可知反应时物质的量的关系是: n(Fe2+)~6n(K2Cr2O7), n(K2Cr2O7)= 0.1000 mol/L×0.01280 L×(100÷20)=6.4×10-3mol;所以n(Fe2+)=6×6.4×10-3mol=3.84×10-2mol. 则聚铁中铁元素的质量分数为[(3.84×10-2mol× 56g/mol)÷ 10.00g] ×100%=21.5% 。
+N2↑+5Cl-+H2O;(3)①实验中需配制1.0mol/L的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为100ml的容量瓶;②实验③中沉淀量由A→B过程中是Al(OH)3被过量的NaOH溶解的反应所致,所发生反应的离子方程式为Al(OH)3+OH-===AlO2-+2H2O;③在100ml的溶液中,焰色反应为黄色,只能含有Na+;向其中加入BaCl2溶液和稀HCl,产生白色沉淀2.33g,证明含有SO42-,其物质的量是2.33g÷233g/mol=0.01mol;向该溶液中加入过量的NaOH溶液,产生白色沉淀,就证明不含有Fe3+,当沉淀达到最大值后沉淀有有所减小,最后还存在沉淀,证明含有Al3+、Mg2+,由于Al3+、Mg2+与CO32-会发生离子反应而不能大量共存,所以不存在CO32-;根据反应方程式:Al3++3OH-=Al(OH)3↓; Mg2++2OH-=Mg(OH)2↓. Al(OH)3+ OH-= AlO2-+ 2H2O.结合图像给出消耗NaOH的物质的量的关系可知:n(Al3+)=0.005mol;n(Mg2+)=(0.035mol-0.005mol×2)÷2=0.01mol。根据电荷守恒可知:Al3+、Mg2+所带的正电荷数是:0.005mol×3+0.01mol×2=0.035mol,溶液中还存在阳离子Na+,而SO42-所带的负电荷数是0.01mol×2=0.02mol,负电荷数小于正电荷数,CO32-不存在,所以一定还存在NO3-。NO3-的浓度可能是:(0.035mol-0.02mol)÷0.1L=0.15 mol/L. (4)根据氧化还原反应中电子转移数目相等可知反应时物质的量的关系是: n(Fe2+)~6n(K2Cr2O7), n(K2Cr2O7)= 0.1000 mol/L×0.01280 L×(100÷20)=6.4×10-3mol;所以n(Fe2+)=6×6.4×10-3mol=3.84×10-2mol. 则聚铁中铁元素的质量分数为[(3.84×10-2mol× 56g/mol)÷ 10.00g] ×100%=21.5% 。
考点:考查物质氧化性大小的比较、弱电解质电离方程式和离子方程式的书写、微粒的确定及浓度和化合物中元素的含量的计算的知识。


科目:高中化学 来源:2015届湖南省益阳市高三上学期第三次模拟考试化学试卷(解析版) 题型:选择题
下列有关溶液组成的描述合理的是
A.常温下在c(H+)=1×10-13mol/L的溶液中能大量存在Mg2+、Cu2+、SO42-、NO3
B.使甲基橙试液变红的溶液中可能大量存在Na+、ClO?、SO42?、I?
C.使PH试纸变蓝的溶液中可大量存在Na+、K+、AlO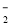 、CO
、CO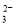
D.常温下,在水电离产生的c(H+)×c(OH-)=1×10-24的溶液中可大量存在Fe2+、Cl-、NO3-、K+
查看答案和解析>>
科目:高中化学 来源:2015届湖南省名校高三第二次联考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是
A.20 g氖气中所含的原子数目为NA
B.25℃时,pH=12的NaHCO3溶液中含有OH-的数目为0.01NA
C.含NA个阴离子的Na2O2溶于水形成1 L溶液,其物质的量浓度为1 mol·L-1
D.常温常压下,6.4 g Cu与40 mL 10 mol·L-1浓HNO3作用,产生NO2分子的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源:2015届湖南省高三10月第二次阶段考试试卷(解析版) 题型:选择题
将足量的CO2不断通入KOH、Ca(OH) 2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
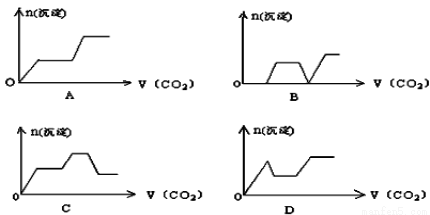
查看答案和解析>>
科目:高中化学 来源:2015届湖南省高三10月第二次阶段考试试卷(解析版) 题型:选择题
存放下列试剂的方法中,有错误并且会引起危险的是( )
A.白磷浸在盛有CS2的敞口试剂瓶中 B.金属钠浸在盛有煤油的试剂瓶中
C.浓硝酸存放在棕色试剂瓶中 D.溴水放在带橡皮塞的试剂瓶中
查看答案和解析>>
科目:高中化学 来源:2015届湖南省高三第二次月考化学试卷(解析版) 题型:选择题
类比(比较)是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观实际。下列说法正确的是( )
A.Fe能置换硫酸铜溶液的铜;则Na也能置换硫酸铜溶液的铜
B.CaC2能水解:CaC2+2H2O==Ca(OH)2+C2H2↑;则Al4C3也能水解:Al4C3+12H2O ==4Al(OH)3↓+3CH4↑
C.工业上电解熔融MgCl2的制取金属镁;则也可以用电解熔融AlCl3的制取金属铝
D.CO2与Na2O2反应生成Na2CO3和O2;则SO2与Na2O2反应生成Na2SO3和O2
查看答案和解析>>
科目:高中化学 来源:2015届湖南省高三第二次月考化学试卷(解析版) 题型:选择题
实验室为监测空气中汞蒸气的含量,通常悬挂有CuI的滤纸,根据滤纸是否变色或颜色发生变化的时间来判断空气中汞的含量,其反应为:4CuI+Hg==Cu2HgI4+2Cu。以下有关说法正确的是( )
A.上述反应中Hg与Cu均发生氧化反应
B.上述反应中CuI既是氧化剂,又是还原剂
C.上述反应的产物Cu2HgI4中,Hg的化合价为+2
D.上述反应中生成 64g Cu时,转移的电子数为2×6.02×1023
查看答案和解析>>
科目:高中化学 来源:2015届湖北黄冈蕲春县第一高级中学高二下期中考试化学卷(解析版) 题型:选择题
乙醇、环丙烷、1-丁烯三种物质组成的混合物中氧元素的质量分数为8.0%,则混合物中氢元素的质量分数为( )
A.12.0% B. 13.0% C. 14.0% D.无法计算
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高三十月阶段性考试化学试卷(解析版) 题型:选择题
我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他材料电池,电池总反应为V2O5+xLi LixV2O5。下列说法中正确的是
LixV2O5。下列说法中正确的是
A.电池在放电时,Li+向负极移动
B.锂在放电时做正极,充电时为阳极
C.该电池充电时阳极的反应为LixV2O5﹣xe-═V2O5+xLi+
D.V2O5只是锂发生反应的载体,不参与电池反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com