
分析 (1)依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{Vm}$,结合分子的结构组成解答;
(2)等物质的量的氧气与臭氧,设物质的量均为1mol,结合分子构成及m=nM计算;
(3)MCl3 26.7g,含有0.600mol Cl-,n(MCl3)=0.2mol,结合M=$\frac{m}{n}$计算;
(4)10克H218O的物质的量为$\frac{10g}{20g/mol}$=0.5mol,1个分子中含18-8=10个中子;
(5)依据微粒数之比等于物质的量之比,结合n=$\frac{m}{M}$计算水的质量;
(6)依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{Vm}$,结合分子的结构组成解答;
(7)依据n=$\frac{V}{Vm}$计算氯化氢的物质的量,依据C=$\frac{n}{V}$计算溶液浓度.
解答 解:(1)n(CH4)=$\frac{8.96L}{22.4L/mol}$=0.4mol,n(HCl)=$\frac{3.01×10{\;}^{22}}{6.02×10{\;}^{23}}$=0.05mol,n(H2S)=$\frac{10.2g}{34g/mol}$=0.3mol,n(NH3)=0.5mol,
由V=nVm可知,物质的量越大,体积越大,则体积最大的是④,由分子构成可知,含氢原子物质的量分别为1.6mol、0.05mol、0.6mol、1.5mol,最多的为①,
故答案为:④;①;
(2)等物质的量的氧气与臭氧,设物质的量均为1mol,则质量之比为1mol×32g/mol:1mol×28g/mol=2:3,
分子个数之比等于物质的量之比,均为1:1,
电子个数之比为1mol×2×8:1mol×3×8=2:3,
故答案为:2:3;1:1;2:3;
(3)MCl3 26.7g,含有0.600mol Cl-,n(MCl3)=0.2mol,则M=$\frac{m}{n}$=$\frac{26.7g}{0.2mol}$=133.5g/mol,金属M的摩尔质量为133.5g/mol-35.5g/mol×3=27g/mol,
故答案为:27g/mol;
(4)10克H218O的物质的量为$\frac{10g}{20g/mol}$=0.5mol,1个分子中含18-8=10个中子,则中子数为0.5mol×10×NA=5NA,
故答案为:5NA.
(5)0.4mol NH3中所含氢原子物质的量为1.2mol;氢原子数之比等于物质的量之比,设水的质量为x,则氢原子物质的量=$\frac{x}{18g/mol}$×2=1.2mol;
x=10.8g
故答案为;10.8g;
(6)0.5molSO2的质量是为0.5mol×64g/mol=32g;在标准状况下的体积为0.5mol×22.4L/mol=11.2L;1个二氧化硫含有2个氧原子,则0.5mol二氧化硫含有氧原子个数为:0.5mol×NA×2=NA;
故答案为:32;11.2;NA;
(7)将标况下22.4L的HCl 溶于水配成200mL的溶液,所溶液的物质的量浓度为:$\frac{\frac{22.4L}{22.4L/mol}}{0.2L}$=5mol/L;
故答案为:5mol/L.
点评 本题考查物质的量的计算,为高频考点,把握物质的量为中心的基本计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
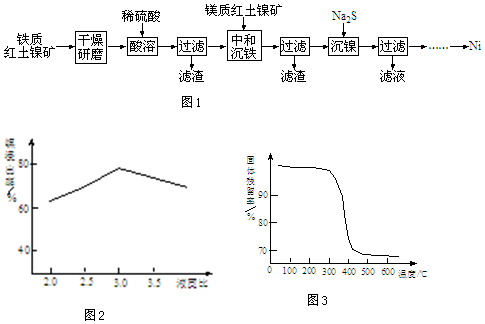
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
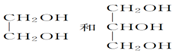

| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
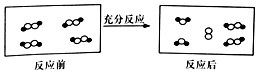 一定条件下,某容器中各微粒在反应前后变化的示意图如图,其中•和○代表不同元素的原子.关于此反应说法正确的是( )
一定条件下,某容器中各微粒在反应前后变化的示意图如图,其中•和○代表不同元素的原子.关于此反应说法正确的是( )| A. | 属于化合反应 | B. | 属于置换反应 | ||
| C. | 属于氧化还原反应 | D. | 属于复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铅蓄电池在放电过程中,负极质量增加,正极质量也增加 | |
| B. | 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0 | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| D. | 相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
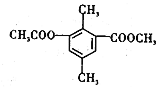
| A. | 分子中不同化学环境的氢共有4种 | |
| B. | 分子中所有的碳原子不可能共平面 | |
| C. | lmol该有机物与足量NaOH溶液反应,最多消耗3mol NaOH | |
| D. | 能发生取代、消去、加成和氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com