
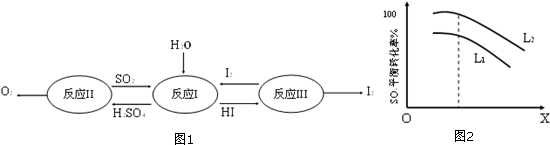
分析 (1)由图可知,反应I为二氧化硫与碘发生氧化还原反应生成硫酸和HI;
(2)分成两层,与溶解性、密度有关;
(3)两层的颜色不同;
(4)H2SO4中c(H+):c(SO42-)=2:1,且HI电离出氢离子;
(5)由图可知,X越大,转化率越低,依据反应是气体体积增大的反应,增大压强平衡逆向进行;
(6)分解反应为吸热反应,温度高,转化率大.
解答 解:(1)由图可知,反应I为二氧化硫与碘发生氧化还原反应生成硫酸和HI,该反应为SO2+2H2O+I2=H2SO4+2HI,
故答案为:SO2+2H2O+I2=H2SO4+2HI;
(2)a.两层溶液的密度存在差,才出现上下层,故a正确;
b.加I2前,H2SO4溶液和HI溶液互溶,与分层无关,故b错误;
c.I2在HI溶液中比在H2SO4溶液中易溶,则碘在不同溶剂中溶解性不同,类似萃取,与分层有关,故c正确;
故答案为:ac;
(3)辨别两层溶液的方法是观察颜色,颜色深的为HI层,颜色浅的为硫酸层,
故答案为:观察颜色,颜色深的为HI层,颜色浅的为硫酸层;
(4)H2SO4层中c(H+):c(SO42-)=2.06:1.其比值大于2的原因是硫酸层中含少量的HI,且HI电离出氢离子,
故答案为:硫酸层中含少量的HI,且HI电离出氢离子;
(5)由图可知,X越大,三氧化硫转化率越低,升高温度转化率增大不符合,增大压强平衡逆向进行,三氧化硫转化率减小,图象符合X表示压强,
故答案为:压强,增大压强平衡逆向进行,三氧化硫转化率减小;
(6)由2SO3(g)=2SO2(g)+O2(g)△H>0,温度高,转化率大,图中等压强时L2对应的转化率大,则L1<L2,
故答案为:L1<L2,分解反应为吸热反应,温度高,三氧化硫转化率大.
点评 本题考查混合物分离提纯及化学平衡等,为高频考点,把握发生的反应、平衡影响因素为解答的关键,侧重分析与应用能力的综合考查,题目难度中等.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2 NA? | |
| B. | 常温下,0.l mol碳酸钠晶体中含有CO32- 的个数为0.1NA | |
| C. | 标准状况下,11.2L 18O2中所含中子数为8NA | |
| D. | 25℃时,l L pH=13的Ba(OH)2溶液中含有的OH- 数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是人类将太阳能转换为电能的常用材料 | |
| B. | 单质硅是制光导纤维的材料 | |
| C. | 粗硅制备高纯度单质硅不涉及氧化还原反应 | |
| D. | 硅能与氢氟酸反应,则硅可以与盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
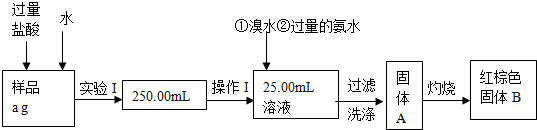

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{22.4b}{5a}$ | B. | $\frac{5a}{11.2b}$ | C. | $\frac{22.4a}{5b}$ | D. | $\frac{11.2b}{5a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯塑可用与制食品包装袋 | |
| B. | 工业上用电解无水氯化铝的方法制单质铝 | |
| C. | 聚氯乙烯塑料的老化是因为发生了加成反应 | |
| D. | 糖类、油脂、蛋白质都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
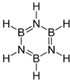 互为等电子体的物质具有相似的结构特征和化学性质.B3N3H6与C6H6(苯)互为等电子体,则关于B3N3H6的说法错误的是( )
互为等电子体的物质具有相似的结构特征和化学性质.B3N3H6与C6H6(苯)互为等电子体,则关于B3N3H6的说法错误的是( )| A. | 其二氯代物有3种同分异构体 | B. | 能发生加成反应和取代反应 | ||
| C. | 不能使酸性KMnO4溶液褪色 | D. | 所有原子都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液(CaCO3):加热 | B. | NaHCO3溶液(Na2CO3):加热 | ||
| C. | H2O(NaCl):蒸馏 | D. | 苯(水):萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向正反应方向移动 | B. | 向逆反应方向移动 | ||
| C. | 平衡不发生移动 | D. | 不发生移动,但容器内压强增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com