
【题目】设NA为阿伏伽德罗常数的值。下列有关叙述正确的是( )
A. 标况下,11.2L氟化氢中含有的分子数目为0.5NA
B. 室温下,21.0g乙烯和丁烯的混合气体中所含的碳原子数目是NA
C. 室温下,2L 0.05mol/L的NH4NO3溶液中所含有的氮原子数目是0.2NA
D. 22.4L Cl2与足量NaOH溶液反应时转移的电子数为NA
科目:高中化学 来源: 题型:
【题目】【化学―选修2:化学与技术】以硫铁矿(主要成分为FeS2)为原料制取硫酸,其矿渣可用来炼铁。生产工艺示意图如下:
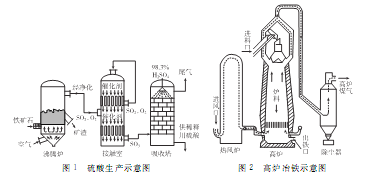
(1)配平煅烧硫铁矿的反应方程式:______FeS2+________O2→_____Fe2O3+______SO2。实际生产中向沸腾炉通入的空气量要大于锻烧硫铁矿所需空气量.其目的是____________________。接触室和热风炉中都装有热交换器,可用反应的余热将通入的气体加热,这样做的好处是_____________________。
(2)生产硫酸时,吸收塔中用98.3%的硫酸吸收而不用水吸收SO3的原因是______________。用含FeS280%的硫铁矿生产硫酸,如果煅烧时有5%的硫损失,SO2转变成SO3的转化率为80%,那么生产98%的浓硫酸3吨,则需要这种硫铁矿___________吨。
(3)CO还原Fe2O3的冶铁过程中,反应物、生成物和温度之间的关系如图所示.
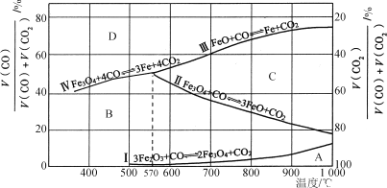
(图中Ⅰ、Ⅱ、Ⅲ、Ⅳ四条曲线是四个化学反应平衡时的气相组成对温度作图得到的;A、B、C、D四个区域分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域)
①冶炼高炉产生的高炉煤气的主要成分有__________和剩余的CO。
②据图分析,下列说法正确的是________(填字母)。
a.温度低于570 ℃时,Fe2O3还原焙烧的产物中不含FeO
b.温度越高,Fe2O3还原焙烧得到的固体物质组成中Fe元素的质量分数越高
c.Fe2O3还原焙烧过程中及时除去CO2有利于提高Fe的产率
③800℃时,混合气体中CO2体积分数为40%时,Fe2O3用CO还原焙烧反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛蒸气跟氢气的混合物,通过灼热的镍催化剂时可发生反应生成乙醇,此反应属于( )
A. 取代反应 B. 消去反应 C. 氧化反应 D. 还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中:①pH试纸的使用 ②过滤 ③蒸发 ④配制一定物质的量浓度溶液,均用到的仪器是 ( )
A. 蒸发皿 B. 玻璃棒
C. 试管 D. 分液漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国晋朝傅玄的《傅鹑觚集·太子少傅箴》中写道:“夫金木无常,方园应行,亦有隐括,习与性形。故近朱者赤,近墨者黑。”这里的“朱”指的是下列物质中的
A. HgS B. Cu C. Cu2O D. Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学们对SO2通入漂粉精溶液的反应进行实验探究:
操作 | 现象 |
取4 g 漂粉精固体,加入100 mL 水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精溶液的pH | pH 试纸先变蓝(约为12),后褪色 |
| 1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的反应中氧化剂与还原剂的物质的量之比为__________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是____________。
(3)兴趣小组将A中产生的白雾引出导入硝酸酸化的AgNO3溶液中,有沉淀产生,据此判断白雾成分为HCl小液滴,该结论合理吗?________(填“合理”或“不合理”),并说明理由__________________。
(4)现象2中溶液变为黄绿色的原因是:随溶液酸性的增强,漂粉精的有效成分和Cl发生反应。该反应的离子方程式为______________。
(5)①将A瓶中混合物过滤、洗涤,得到沉淀X,X的成分是____________(填化学式);
②用离子方程式解释现象3中黄绿色褪去的原因____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3 溶液再生,其装置示意图如下:
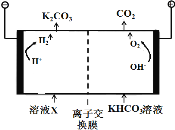
①在阳极区发生的反应包括 和H++HCO3-![]() H2O+CO2↑。
H2O+CO2↑。
②简述CO32-在阴极区再生的原理 。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。已知:25 ℃,101 KPa下:
H2(g)+ ![]() O2(g)
O2(g)![]() H2O(g)ΔH1=-242kJ·mol-1
H2O(g)ΔH1=-242kJ·mol-1
CH3OH(g)+(3/2) O2(g)![]() CO2(g)+2H2O(g)ΔH2=-676kJ·mol-1
CO2(g)+2H2O(g)ΔH2=-676kJ·mol-1
①写出CO2和H2生成气态甲醇等产物的热化学方程式 。
②下面表示合成甲醇的反应的能量变化示意图,其中正确的是 (填字母序号)。
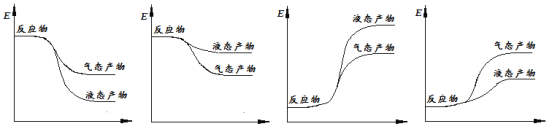
A B C D
(3)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如下:
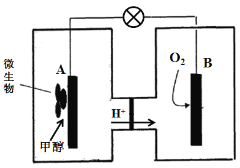
①该电池外电路电子的流动方向为 (填写“从A到B”或“从B到A”)。
②A电极附近甲醇发生的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质的比较,不能用元素周期律解释的是
A. 稳定性:H2O > NH3 B. 碱性:NaOH > Al(OH)3
C. 氧化性:F2 >Cl2 D. 酸性:CH3COOH > H2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com