
【题目】下列图示与对应的叙述正确的是( )
A.  若要除去CuSO4溶液中的Fe3+,需要调节溶液的pH在7左右
若要除去CuSO4溶液中的Fe3+,需要调节溶液的pH在7左右
B.  表示反应4CO(g)+2NO2(g)N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
表示反应4CO(g)+2NO2(g)N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
C.  表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH的电离平衡常数
表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH的电离平衡常数
D.  表示25℃时,向0.1 molL﹣1的NH4Cl溶液中滴加0.1 molL﹣1的盐酸,溶液中c(H+)/c(NH4+)随盐酸体积的变化关系
表示25℃时,向0.1 molL﹣1的NH4Cl溶液中滴加0.1 molL﹣1的盐酸,溶液中c(H+)/c(NH4+)随盐酸体积的变化关系
【答案】BD
【解析】
A. 图示显示在pH = 4 时Fe3+完全沉淀,pH = 6 时Cu2+完全沉淀,据此分析;
B. 转化率 = ![]() ×100 %,结合平衡向正向移动分析作答;
×100 %,结合平衡向正向移动分析作答;
C. 弱电解质越弱越电离;
D. NH4Cl水解显酸性,加盐酸抑制其水解。
A. 在pH = 4 时Fe3+完全沉淀,Cu2+开始沉淀,则要除去CuSO4溶液中的Fe3+,需要调节溶液的pH在4左右,故A项错误;
B. 根据反应4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g)可知,保持其他条件不变,增大CO的物质的量,反应正向移动,即NO2的转化率增大,则NO2的转化率:c>b>a,故B项正确;
N2(g)+4CO2(g)可知,保持其他条件不变,增大CO的物质的量,反应正向移动,即NO2的转化率增大,则NO2的转化率:c>b>a,故B项正确;
C. 从图中可以看出,体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,加水稀释相同量时HX的pH增大曲线较为平缓,则说明HX的酸性比CH3COOH弱,即25 ℃时HX的电离平衡常数大于CH3COOH的电离平衡常数,故C项错误;
D. NH4Cl在溶液中发生水解,其方程式为:NH4+ +H2O![]() NH3·H2O + H+,向0.1 mol·L-1的NH4Cl溶液中滴加0.1 mol·L-1的盐酸时,随盐酸体积的增大,混合溶液中酸性增强,且NH4+的水解抑制程度加大,则c(H+)/c(NH4+)的比值逐渐增大,与图像相符,故D项正确;
NH3·H2O + H+,向0.1 mol·L-1的NH4Cl溶液中滴加0.1 mol·L-1的盐酸时,随盐酸体积的增大,混合溶液中酸性增强,且NH4+的水解抑制程度加大,则c(H+)/c(NH4+)的比值逐渐增大,与图像相符,故D项正确;
答案选BD。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】物质Ⅲ(2,3-二氢苯并呋喃)是一种重要的精细化工原料,其合成的部分流程如下:

下列叙述正确的是
A. 物质Ⅲ的核磁共振氢谱图显示有四种不同环境的氢
B. 物质Ⅰ在NaOH醇溶液中加热可发生消去反应
C. 物质Ⅱ中所有原子可能位于同一平面内
D. 物质Ⅲ与足量H2加成所得产物分子中有2个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 电解饱和MgCl2溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B. 向酸性KMnO4溶液中通入SO2:3SO2+2MnO4-+4OH-===2MnO2↓+3SO42-+2H2O
C. 向Fe(NO3)2稀溶液中滴加足量氢碘酸:3Fe2++NO3-+4H+===3Fe3++NO↑+2H2O
D. 向NaClO溶液中通入足量CO2:ClO-+CO2+H2O===HClO+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有①0.112L水;②3.01×1023个氯化氢分子;③13.6 g H2S气体;④0.2 mol氨气,下列对这四种物质的关系由小到大排列正确的是( )
A. 分子数:①③②④B. 密度:④①③②
C. 质量①④③D. 氢原子数:②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用pH传感器测得0.10mol/LNa2CO3溶液从55℃升高至85℃的pH如图所示。在55℃升高至85℃升温过程中,下列说法正确的是( )
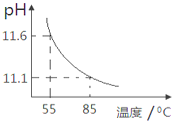
A.c(H+)增大,c(OH-)减小 B.c(CO32-)/c(HCO3-)比值不断增大
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.10 D.c(OH-)-c(HCO3-)-c(H2CO3)=10-11.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】见下图(A)处通入Cl2,当关闭(B)阀时,(C)处的湿润的红布条没有明显变化,当打开(B)阀时,(C)处的湿润红布条逐渐褪色,则(D)瓶中装的溶液是

A. 浓硫酸B. NaOH溶液C. 水D. NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法中正确的是( )
①0.5mol O3与11.2L O2所含的分子数一定相等
②标准状况下,28g CO与N2的混合气体的体积约为22.4L
③通常状况下,NA个CO2分子占有的体积为22.4L
④常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
⑤常温下,4.4g CO2和N2O(不反应)混合物中所含有的电数为2.2NA
⑥标准状况下,22.4L SO3含有的分子数为NA
⑧在常温常压下,1mol O2含有的原子数为2NA
A. ①③⑥⑧B. ②④⑤⑧C. ①③⑤⑧D. ②③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-115. 6 kJ·mol-1, H2(g)+Cl2(g)=
2Cl2(g)+2H2O(g) ΔH=-115. 6 kJ·mol-1, H2(g)+Cl2(g)=
2HCl(g)ΔH=-184 kJ·mol-1。
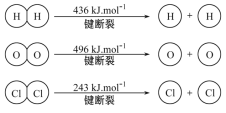
①H2与O2反应生成气态水的热化学方程式是___________。
②断开1 mol H—O键所需能量为______ kJ。
③高温下H2O可分解生成分子或原子。高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是________,物质的量之比为2:1的A、H2化学能较低的物质是________。

(2)已知ΔG=ΔH—T·ΔS。在100 kPa、298. 15 K时石灰石分解反应CaCO3(s)= CaO(s)+CO2(g)的ΔH=+178. 3 kJ·mol-1,ΔS=+160. 4 J·mol-1·K-1
①从吉布斯自由能变(ΔG)的角度说明该反应高温下能自发进行的原因___________________。
②则该反应自发进行的最低温度为__________K。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氰酸(HCN)是一种剧毒类弱酸,具有苦杏仁气味,将其加水不断稀释,下列各量始终保持增大的是
A. Ka(HCN) B. c(H+) C. c(CN-)/c(HCN) D. C(HCN)/ c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com